No.330 - ウイルスでがんを治療する [科学]
No.314「人体に380兆のウイルス」の最後の方に、東京大学医科学研究所の藤堂具紀教授が開発した "ウイルスによるがん治療薬" が承認される見通しになったとのメディア記事を紹介しました(2021年6月11日に承認)。今回はその治療薬の話を詳しく紹介します。
承認の対象となったがんは、脳腫瘍の一種である悪性神経膠腫で、条件・期限付き承認です。期限は7年で、7年後にそれまでの治療結果をもとに再度、承認の申請の必要があります。またすべての悪性神経膠腫の患者さんに使えるのではなく制限がかかっています(後述)。とはいえ、これは画期的な治療薬です。つまり、
という3つの点で画期的です。この治療薬の開発名は G47Δで、WHOが決めた一般名称は「テセルバツレブ」、製品名は「デリタクト注」です("注" は注射薬の意味。製造する製薬会社は第一三共株式会社)。
ウイルス療法薬とは「がん細胞にのみ感染するウイルスを投与し、そのウイルスが次々とがん細胞に感染し破壊することでがんを治療する」というものです。どうしてそんなこと出来るのか、また、この薬による治療の承認対象となった脳腫瘍とはどんなものかについて以下にまとめます。
藤堂教授は 2021年末に『がん治療革命 ウイルスでがんを治す』(文春新書 2021.12.20。以下「本書」)という本を出されました。この治療薬の開発の歴史からはじまって、がんを治療するメカニズム、臨床試験の結果、承認に至るプロセスなどがまとめられています。その一部を紹介します。
脳腫瘍
私事になりますが、私と同期入社の M さんは脳腫瘍により 30代で亡くなりました。入院されてから数ヶ月だったと思います。アッという間という感じでした。働き盛りというか、これから真の働き盛りを迎えるその前に、奥様と子供を残して "突如として" 命を奪われた。残酷なものだと思いました。私が G47Δ に強く興味をもったのは、この記憶があったからです。
私たちの頭蓋骨の内側には "髄膜" があり(硬膜・クモ膜・軟膜の3層構造)、その内側に脳組織があります。脳腫瘍とは頭蓋骨の内側にできる腫瘍(=がん)の総称です。
脳腫瘍は医学的に細分すると100種類以上ありますが、大きくは「原発性か転移性か」と「良性か悪性か」に分類できます。「原発性」は脳組織そのものから生じた腫瘍であり、「転移性」は体の他の部位の腫瘍が脳に転移したものです。本書でとりあげているのは原発性の脳腫瘍です。原発性脳腫瘍は年間で1万人あたり約1人が発症し、お年寄りから子供まで幅広い年齢層にわたります。
原発性脳腫瘍には「良性」と「悪性」があり 6割が良性、4割が悪性です。この区別は腫瘍ができる部位の違いです。良性脳腫瘍は脳組織の外側にできた腫瘍で、たとえば髄膜にできる髄膜腫です。良性脳腫瘍は脳組織を損傷することなく切除することが可能です。従って大半は外科手術で治ります。5年生存率は、腫瘍の種類によって違いますが、97%~99% といった高い数字です。
一方、悪性脳腫瘍は、がん細胞が脳組織の中に染み込むように散らばっている腫瘍で(専門的には "浸潤")、手術で完全に取り除くことは困難です。他の臓器の腫瘍のように「なるべく広く切除しておこう」なんてことは、脳ではできない。脳の深部の腫瘍になると後遺症を出さずに摘出するのは困難です。
悪性脳腫瘍で最も多いのは「グリオーマ(=神経膠腫)」で、「グリア細胞」にできる腫瘍です。グリア細胞は脳神経細胞を取り囲むように存在し、神経をささえています。"グリア" とはギリシャ語で膠の意味で、日本語では「神経膠細胞」です。
悪性脳腫瘍はその "悪性度"(がん細胞の増殖の早さなど)によってグレード2~4に分類されますが(グレード1 は良性)、グリオーマと診断されてからの余命は、グレード2で7~8年、グレード3 で約3年、グレード4 で約1年です。グリオーマは、現代の医療ではほぼ 100% 治らないがんなのです。
このグリオーマの治療を対象として、2021年6月に承認されたウイルス治療薬が G47Δ です。これはヘルペスウイルスを改変して作られました。
ヘルペスウイルス
ヒトに感染して病気を引き起こすヘルペスウイルスは 8種類ありますが、主なものは次の3つです。
G47Δ に使われるのは ① の「単純ヘルペスウイルス 1型(HSV-1)」で、口唇ヘルペス(口唇に湿疹ができる)を起こします。このウイルスは人との直接的な接触によって感染しますが、初めて感染したときには大抵の人は症状が出ず、ウイルスは神経細胞の中に潜り込んでしまいます。これを「潜伏感染」と言います。そして、何らかの原因で体の抵抗力が落ちているときに症状を引き起こす。症状は10日から2週間程度で治まります。症状を軽くする薬もあります。
潜伏感染している HSV-1 を退治することは、現代医学ではできません。感染したらずっとその人に潜み続けます。そのため、日本の成人の約8割がこのウイルスに対する抗体を持っています。つまり感染しているわけです。20代から30代では約半数、60代以降ではほとんどの人が感染しているというデータもあります。つまり HSV-1 は「非常にありふれた身近なウイルス」なのです。
このウイルスはありふれた存在であるため、よく研究されていて、ウイルスの遺伝子(80以上ある)とその機能が解明されています。そのためウイルスの遺伝子を改変してがん治療に使うのに適しています。HSV-1 は人間がコントロールしやすい。これが重要な点です。
また万一、改変したウイルスを人に投与して病気を発症したとしても、ヘルペスウイルスに対する抗ウイルス薬があるので、投与を中断して治療が可能です。
さらに HSV-1 は、ほぼあらゆる種類のヒトの細胞に感染します。これもウイルスをがん治療に使うときに好都合です。
がん細胞を殺すメカニズム
G47Δ は単純ヘルペスウイルス 1型(HSV-1)の次の3つの遺伝子を改変し、遺伝子が働かないようにしたものです。
遺伝子1:γ34.5
この遺伝子の働きを止めると、口唇ヘルペスなどの病気を起こさなくなります。
またこの遺伝子は、感染した細胞の自滅を防ぐ機能を持っています。ヒトの正常な細胞は、ウイルスに感染すると細胞内のタンパク質合成を停止させ、ウイルスとともに自滅します。これによってウイルス感染の広がりを防いでいます。HSV-1 のこの遺伝子は、その自滅を阻止します。従ってこの遺伝子の働きを止めると、ヒトの細胞の自滅機能が有効なままであり、ウイルスの感染は拡大しません。
その一方で、がん細胞は自滅する機能に異常があり(だから増殖し続ける)、この遺伝子の働きを止めた HSV-1 であってもウイルスは増殖が可能です。つまり「正常細胞では細胞の自滅により増殖できないが、がん細胞では増殖できる」ことになります。その結果として HSV-1 はがん細胞を次々と破壊していきます。
遺伝子2:ICP6
HSV-1 は内部に DNA を持つ "DNAウイルス" で、細胞に入り込むとそのDNAを複製して増殖します。このとき、DNAを合成する酵素が必要になりますが、ICP6はその酵素を作り出す遺伝子です。
骨髄細胞や腸管の表面細胞などの増殖を繰り返している細胞を除いて、正常な細胞の中には DNA合成酵素が(ほとんど)ありません。そのため HSV-1 は ICP6遺伝子によって合成酵素を作り出して増殖するわけです。従って、ICP6の働きを止めた HSV-1 は正常細胞の中では増殖できなくなります
一方、分裂を繰り返してどんどん増えているがん細胞には DNA合成酵素がたくさんあります。従って ICP6の働きを止めた HSV-1 であっても、がん細胞の中では増殖できます。つまり「正常細胞では増殖できないが、がん細胞では増殖できる」ことになります。
遺伝子3:α47
免疫(獲得免疫)の基本的なしくみは、細胞内にあるタンパク質の断片(ペプチド)が細胞表面に提示されることから始まります。このとき、ウイルスに感染した細胞は自己由来のペプチドに加えて、ウイルスのタンパク質由来のペプチドが提示される。この "非自己の提示 = 抗原提示" を免疫細胞である T細胞が特異的に認識して免疫が発動します。ヘルパーT細胞が認識すると B細胞を活性化して抗体の生産が始まり、キラーT細胞が認識するとウイルスに感染した細胞を直接破壊します(No.69「自己と非自己の科学(1)」参照)。
HSV-1 の α47 という遺伝子は、細胞表面にウイルスのタンパク質が提示されないようにする作用があります。これにより HSV-1 はヒトの免疫系の監視を逃れて感染を拡大できるのです。
一方、がん細胞は、あの手この手を使ってヒトの免疫システムから逃れ、増え続けています。そのがん細胞に α47 の働きを止めた HSV-1 が感染すると、HSV-1 由来のタンパク質(の断片=ペプチド)が、がん細胞の表面に提示される。これがヒトの免疫細胞に認識され、がん細胞に対する抗体ができます。つまり、HSV-1の増殖によってがん細胞が破壊されることに加えて、ヒトの免疫システムによってがんを縮小でき、より一層の治療効果が期待できます。
以上の、3つの遺伝子が働かないように操作した HSV-1 は、がん細胞のみで増殖し、がん細胞を破壊します。増殖してできた HSV-1 がほかのがん細胞に次々と感染して破壊していきます。また、免疫細胞もがん細胞を認識できるようになり、抗体でがん細胞を死滅させる。これが G47Δ によるがん治療の原理です。
第2相臨床試験
G47Δ の有効性を確認する第2相臨床試験は、2015年5月から2020年4月まで行われました。その結果が本書に書かれています。臨床試験の対象は膠芽腫の患者さんで、標準治療(手術・放射線・抗がん剤)治療を行ったあとに膠芽腫が再発した患者さんです。膠芽腫はグリオーマ(神経膠腫)の一種ですが、進行が早く、悪性度が最も高いものです(=グレード4)。30人を対象に治療を行う計画で臨床試験が始まりました。
この第2相臨床試験では、13人目の患者さんが治療を始めてから1年が経過した時点で、治療開始後1年以上生存した患者さんが 92.3%(13例中の12例)に達しました。標準治療の場合、再発した膠芽腫の患者さんが1年以上生存する率は 14% です。このため、G47Δ の第2相臨床試験は「有効中止」となりました。これは "有効性が明らかになったので中止してよい" というものです。極めてめずらしいことです。
有効中止になったため、第2相臨床試験に参加した患者さんは19人になりました。この19人の患者さんのうち治療後1年以上生存したのは16人、治療後に生存した期間の中央値は20.2ヶ月でした。そして19人のうち2021年11月時点で3人の方が生存しています。
第2相臨床試験が有効中止になり、かつ G47Δ が「希少疾病用再生医療等製品」に指定されたため、第3相臨床試験は省略されることになりました。そして2021年6月の承認となったわけです。
G47Δ の意義
G47Δ ががん細胞を殺すメカニズムで分かることは、この治療薬は悪性脳腫瘍のためだけのものではなく、白血病のような血液がん以外のがん(=固形がん)すべてに有効なことです。実際、前立腺がんや悪性胸膜中皮腫(一つの原因がアスベストの吸引)の臨床試験が始まっています。
現代医学では治療が困難とされるがんがあります。悪性脳腫瘍のほかに、悪性中皮腫、多発性肝細胞がん、膵がん、胆管がん、膀胱がんなどです。これらに対し G47Δ は特に有効な治療薬となるはずです。
また、G47Δ の発展形として HSV-1 の遺伝子の中に「がん治療に効果のある遺伝子」と組み込むことが考えられます。ヒトの免疫系を刺激する遺伝子などです。
たとえば、インターロイキン12(IL-12)を生成する遺伝子を HSV-1 に組み込むと、がん細胞に感染したときに IL-12 がどんどん出されるようになる。分泌された IL-12 はヒトの免疫細胞を刺激し、強い抗がん免疫作用が引き起こされます。これはマウスですでに実験済みで、成果があがっています。
ある少女の手紙
本書に藤堂教授の患者さんだった少女が教授に宛てた手紙のことが出てきます。このあたりは本書の中で最も "思いのこもった" 文章です。少々長くなりますが引用してみます。下線は原文にはありません。また、漢数字を算用数字に変更しました。原文の段落は空行にしてあります。
藤堂教授の "何とかしたい" という思いが伝わってくる文章です。しかしその思いとは裏腹に、仮に D さんが現時点で脳腫瘍を発症したとしても G47Δ による治療はできないのです。それが次です。
少女のウイルス治療はできない
藤堂教授がその手紙を研究室に掲げている D さんは、グリオーマでも最も悪性度の高いグレードⅣで、脳幹にできていました。この「脳幹にできたグリオーマ」の治療は、現状では G47Δ による治療ができません。G47Δ の承認条件からはずれるからです。そのあたりの事情が次です。
この「脳幹の脳腫瘍の治療」の承認の件を含め、G47Δ にはまだまだ乗り越えなければならない課題があります。"ウイルス治療を希望する悪性脳腫瘍の患者さん全てに G47Δ を届ける" という藤堂教授の目標の実現には、まだ長い道のりが必要です。
本書には「第6章 日本への提言」と題する章があって、日本の治療薬の開発に関する数々の提言が書かれています。G47Δ は日本で初めてのウイルス治療薬という画期的な薬だからこそ、その製品化(承認)までのプロセスを一度経験すると日本の新薬開発体制の数々の問題点(ないしは日本で画期的な新薬の開発が困難な理由)がクリアに見えてくる。そういうことだと思いました。
2022年5月31日の日本経済新聞に、ウイルス使ったがん治療の現状をリポートした記事が掲載されました。藤堂教授の研究のほか、ウイルス療法の研究の現状がコンパクトにまとめられています。ここに記事を引用しておきます。
承認の対象となったがんは、脳腫瘍の一種である悪性神経膠腫で、条件・期限付き承認です。期限は7年で、7年後にそれまでの治療結果をもとに再度、承認の申請の必要があります。またすべての悪性神経膠腫の患者さんに使えるのではなく制限がかかっています(後述)。とはいえ、これは画期的な治療薬です。つまり、
| ウイルス療法の治療薬が日本で初めて承認された。 | |
| 脳腫瘍を対象にしたウイルス療法薬が世界で初めて承認された。 | |
| 開発から製造までの全工程を日本で行った国産ウイルス療法薬である。 |
ウイルス療法薬とは「がん細胞にのみ感染するウイルスを投与し、そのウイルスが次々とがん細胞に感染し破壊することでがんを治療する」というものです。どうしてそんなこと出来るのか、また、この薬による治療の承認対象となった脳腫瘍とはどんなものかについて以下にまとめます。
藤堂教授は 2021年末に『がん治療革命 ウイルスでがんを治す』(文春新書 2021.12.20。以下「本書」)という本を出されました。この治療薬の開発の歴史からはじまって、がんを治療するメカニズム、臨床試験の結果、承認に至るプロセスなどがまとめられています。その一部を紹介します。
脳腫瘍
私事になりますが、私と同期入社の M さんは脳腫瘍により 30代で亡くなりました。入院されてから数ヶ月だったと思います。アッという間という感じでした。働き盛りというか、これから真の働き盛りを迎えるその前に、奥様と子供を残して "突如として" 命を奪われた。残酷なものだと思いました。私が G47Δ に強く興味をもったのは、この記憶があったからです。
私たちの頭蓋骨の内側には "髄膜" があり(硬膜・クモ膜・軟膜の3層構造)、その内側に脳組織があります。脳腫瘍とは頭蓋骨の内側にできる腫瘍(=がん)の総称です。
脳腫瘍は医学的に細分すると100種類以上ありますが、大きくは「原発性か転移性か」と「良性か悪性か」に分類できます。「原発性」は脳組織そのものから生じた腫瘍であり、「転移性」は体の他の部位の腫瘍が脳に転移したものです。本書でとりあげているのは原発性の脳腫瘍です。原発性脳腫瘍は年間で1万人あたり約1人が発症し、お年寄りから子供まで幅広い年齢層にわたります。
原発性脳腫瘍には「良性」と「悪性」があり 6割が良性、4割が悪性です。この区別は腫瘍ができる部位の違いです。良性脳腫瘍は脳組織の外側にできた腫瘍で、たとえば髄膜にできる髄膜腫です。良性脳腫瘍は脳組織を損傷することなく切除することが可能です。従って大半は外科手術で治ります。5年生存率は、腫瘍の種類によって違いますが、97%~99% といった高い数字です。
一方、悪性脳腫瘍は、がん細胞が脳組織の中に染み込むように散らばっている腫瘍で(専門的には "浸潤")、手術で完全に取り除くことは困難です。他の臓器の腫瘍のように「なるべく広く切除しておこう」なんてことは、脳ではできない。脳の深部の腫瘍になると後遺症を出さずに摘出するのは困難です。
悪性脳腫瘍で最も多いのは「グリオーマ(=神経膠腫)」で、「グリア細胞」にできる腫瘍です。グリア細胞は脳神経細胞を取り囲むように存在し、神経をささえています。"グリア" とはギリシャ語で膠の意味で、日本語では「神経膠細胞」です。
悪性脳腫瘍はその "悪性度"(がん細胞の増殖の早さなど)によってグレード2~4に分類されますが(グレード1 は良性)、グリオーマと診断されてからの余命は、グレード2で7~8年、グレード3 で約3年、グレード4 で約1年です。グリオーマは、現代の医療ではほぼ 100% 治らないがんなのです。
このグリオーマの治療を対象として、2021年6月に承認されたウイルス治療薬が G47Δ です。これはヘルペスウイルスを改変して作られました。
ヘルペスウイルス
ヒトに感染して病気を引き起こすヘルペスウイルスは 8種類ありますが、主なものは次の3つです。
| 単純ヘルペスウイルス 1型(HSV-1) 口唇ヘルペス、ヘルペス性歯肉口内炎、ヘルペス性角膜炎などを引き起こします。 | |
| 単純ヘルペスウイルス 2型(HSV-2) 主に性器ヘルペスの原因となるウイルス。 | |
| 水痘・帯状疱疹ウイルス(HSV-3) 水ぼうそう(水痘)の原因となるウイルス。水ぼうそうが治ったあとも神経細胞に潜伏し、加齢や免疫力の低下で暴れ出して帯状疱疹を起こします。 |
G47Δ に使われるのは ① の「単純ヘルペスウイルス 1型(HSV-1)」で、口唇ヘルペス(口唇に湿疹ができる)を起こします。このウイルスは人との直接的な接触によって感染しますが、初めて感染したときには大抵の人は症状が出ず、ウイルスは神経細胞の中に潜り込んでしまいます。これを「潜伏感染」と言います。そして、何らかの原因で体の抵抗力が落ちているときに症状を引き起こす。症状は10日から2週間程度で治まります。症状を軽くする薬もあります。
潜伏感染している HSV-1 を退治することは、現代医学ではできません。感染したらずっとその人に潜み続けます。そのため、日本の成人の約8割がこのウイルスに対する抗体を持っています。つまり感染しているわけです。20代から30代では約半数、60代以降ではほとんどの人が感染しているというデータもあります。つまり HSV-1 は「非常にありふれた身近なウイルス」なのです。
このウイルスはありふれた存在であるため、よく研究されていて、ウイルスの遺伝子(80以上ある)とその機能が解明されています。そのためウイルスの遺伝子を改変してがん治療に使うのに適しています。HSV-1 は人間がコントロールしやすい。これが重要な点です。
また万一、改変したウイルスを人に投与して病気を発症したとしても、ヘルペスウイルスに対する抗ウイルス薬があるので、投与を中断して治療が可能です。
さらに HSV-1 は、ほぼあらゆる種類のヒトの細胞に感染します。これもウイルスをがん治療に使うときに好都合です。
がん細胞を殺すメカニズム
G47Δ は単純ヘルペスウイルス 1型(HSV-1)の次の3つの遺伝子を改変し、遺伝子が働かないようにしたものです。
遺伝子1:γ34.5
この遺伝子の働きを止めると、口唇ヘルペスなどの病気を起こさなくなります。
またこの遺伝子は、感染した細胞の自滅を防ぐ機能を持っています。ヒトの正常な細胞は、ウイルスに感染すると細胞内のタンパク質合成を停止させ、ウイルスとともに自滅します。これによってウイルス感染の広がりを防いでいます。HSV-1 のこの遺伝子は、その自滅を阻止します。従ってこの遺伝子の働きを止めると、ヒトの細胞の自滅機能が有効なままであり、ウイルスの感染は拡大しません。
その一方で、がん細胞は自滅する機能に異常があり(だから増殖し続ける)、この遺伝子の働きを止めた HSV-1 であってもウイルスは増殖が可能です。つまり「正常細胞では細胞の自滅により増殖できないが、がん細胞では増殖できる」ことになります。その結果として HSV-1 はがん細胞を次々と破壊していきます。
遺伝子2:ICP6
HSV-1 は内部に DNA を持つ "DNAウイルス" で、細胞に入り込むとそのDNAを複製して増殖します。このとき、DNAを合成する酵素が必要になりますが、ICP6はその酵素を作り出す遺伝子です。
骨髄細胞や腸管の表面細胞などの増殖を繰り返している細胞を除いて、正常な細胞の中には DNA合成酵素が(ほとんど)ありません。そのため HSV-1 は ICP6遺伝子によって合成酵素を作り出して増殖するわけです。従って、ICP6の働きを止めた HSV-1 は正常細胞の中では増殖できなくなります
一方、分裂を繰り返してどんどん増えているがん細胞には DNA合成酵素がたくさんあります。従って ICP6の働きを止めた HSV-1 であっても、がん細胞の中では増殖できます。つまり「正常細胞では増殖できないが、がん細胞では増殖できる」ことになります。
遺伝子3:α47
免疫(獲得免疫)の基本的なしくみは、細胞内にあるタンパク質の断片(ペプチド)が細胞表面に提示されることから始まります。このとき、ウイルスに感染した細胞は自己由来のペプチドに加えて、ウイルスのタンパク質由来のペプチドが提示される。この "非自己の提示 = 抗原提示" を免疫細胞である T細胞が特異的に認識して免疫が発動します。ヘルパーT細胞が認識すると B細胞を活性化して抗体の生産が始まり、キラーT細胞が認識するとウイルスに感染した細胞を直接破壊します(No.69「自己と非自己の科学(1)」参照)。
HSV-1 の α47 という遺伝子は、細胞表面にウイルスのタンパク質が提示されないようにする作用があります。これにより HSV-1 はヒトの免疫系の監視を逃れて感染を拡大できるのです。
一方、がん細胞は、あの手この手を使ってヒトの免疫システムから逃れ、増え続けています。そのがん細胞に α47 の働きを止めた HSV-1 が感染すると、HSV-1 由来のタンパク質(の断片=ペプチド)が、がん細胞の表面に提示される。これがヒトの免疫細胞に認識され、がん細胞に対する抗体ができます。つまり、HSV-1の増殖によってがん細胞が破壊されることに加えて、ヒトの免疫システムによってがんを縮小でき、より一層の治療効果が期待できます。
以上の、3つの遺伝子が働かないように操作した HSV-1 は、がん細胞のみで増殖し、がん細胞を破壊します。増殖してできた HSV-1 がほかのがん細胞に次々と感染して破壊していきます。また、免疫細胞もがん細胞を認識できるようになり、抗体でがん細胞を死滅させる。これが G47Δ によるがん治療の原理です。
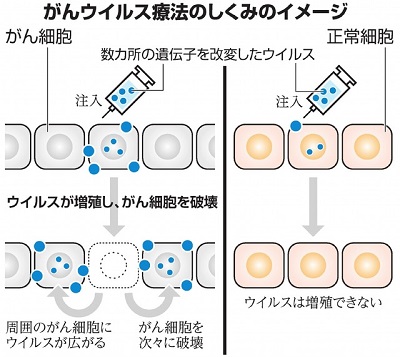
|
癌のウイルス治療のイメージ |
(朝日新聞デジタル 2021.5.24 より) |
第2相臨床試験
G47Δ の有効性を確認する第2相臨床試験は、2015年5月から2020年4月まで行われました。その結果が本書に書かれています。臨床試験の対象は膠芽腫の患者さんで、標準治療(手術・放射線・抗がん剤)治療を行ったあとに膠芽腫が再発した患者さんです。膠芽腫はグリオーマ(神経膠腫)の一種ですが、進行が早く、悪性度が最も高いものです(=グレード4)。30人を対象に治療を行う計画で臨床試験が始まりました。
この第2相臨床試験では、13人目の患者さんが治療を始めてから1年が経過した時点で、治療開始後1年以上生存した患者さんが 92.3%(13例中の12例)に達しました。標準治療の場合、再発した膠芽腫の患者さんが1年以上生存する率は 14% です。このため、G47Δ の第2相臨床試験は「有効中止」となりました。これは "有効性が明らかになったので中止してよい" というものです。極めてめずらしいことです。
有効中止になったため、第2相臨床試験に参加した患者さんは19人になりました。この19人の患者さんのうち治療後1年以上生存したのは16人、治療後に生存した期間の中央値は20.2ヶ月でした。そして19人のうち2021年11月時点で3人の方が生存しています。
第2相臨床試験が有効中止になり、かつ G47Δ が「希少疾病用再生医療等製品」に指定されたため、第3相臨床試験は省略されることになりました。そして2021年6月の承認となったわけです。
G47Δ の意義
G47Δ ががん細胞を殺すメカニズムで分かることは、この治療薬は悪性脳腫瘍のためだけのものではなく、白血病のような血液がん以外のがん(=固形がん)すべてに有効なことです。実際、前立腺がんや悪性胸膜中皮腫(一つの原因がアスベストの吸引)の臨床試験が始まっています。
|
また、G47Δ の発展形として HSV-1 の遺伝子の中に「がん治療に効果のある遺伝子」と組み込むことが考えられます。ヒトの免疫系を刺激する遺伝子などです。
たとえば、インターロイキン12(IL-12)を生成する遺伝子を HSV-1 に組み込むと、がん細胞に感染したときに IL-12 がどんどん出されるようになる。分泌された IL-12 はヒトの免疫細胞を刺激し、強い抗がん免疫作用が引き起こされます。これはマウスですでに実験済みで、成果があがっています。
ある少女の手紙
本書に藤堂教授の患者さんだった少女が教授に宛てた手紙のことが出てきます。このあたりは本書の中で最も "思いのこもった" 文章です。少々長くなりますが引用してみます。下線は原文にはありません。また、漢数字を算用数字に変更しました。原文の段落は空行にしてあります。
|
藤堂教授の "何とかしたい" という思いが伝わってくる文章です。しかしその思いとは裏腹に、仮に D さんが現時点で脳腫瘍を発症したとしても G47Δ による治療はできないのです。それが次です。
少女のウイルス治療はできない
藤堂教授がその手紙を研究室に掲げている D さんは、グリオーマでも最も悪性度の高いグレードⅣで、脳幹にできていました。この「脳幹にできたグリオーマ」の治療は、現状では G47Δ による治療ができません。G47Δ の承認条件からはずれるからです。そのあたりの事情が次です。
|
この「脳幹の脳腫瘍の治療」の承認の件を含め、G47Δ にはまだまだ乗り越えなければならない課題があります。"ウイルス治療を希望する悪性脳腫瘍の患者さん全てに G47Δ を届ける" という藤堂教授の目標の実現には、まだ長い道のりが必要です。
本書には「第6章 日本への提言」と題する章があって、日本の治療薬の開発に関する数々の提言が書かれています。G47Δ は日本で初めてのウイルス治療薬という画期的な薬だからこそ、その製品化(承認)までのプロセスを一度経験すると日本の新薬開発体制の数々の問題点(ないしは日本で画期的な新薬の開発が困難な理由)がクリアに見えてくる。そういうことだと思いました。
(次回に続く)
| 補記 |
2022年5月31日の日本経済新聞に、ウイルス使ったがん治療の現状をリポートした記事が掲載されました。藤堂教授の研究のほか、ウイルス療法の研究の現状がコンパクトにまとめられています。ここに記事を引用しておきます。
|
(2022.5.31)
2022-02-05 13:50
nice!(0)





