No.69 - 自己と非自己の科学(1) [本]
理系学問からの思考
No.56「強い者は生き残れない」で、進化生物学者・吉村仁氏の同名の本(新潮選書 2009)の内容から、どういう生物が生き残ってきたかについての学問的知見を紹介しました。ここで以下のように書きました。
| ふつう人間や社会を研究するのは文学、哲学、心理学、社会学、政治学、経済学などの、いわゆる文化系学問だと見なされています。それは正しいのですが、理科系の学問、特に生命科学の分野、物理学、数学などから得られた知見が、人間の生き方や社会のありかたに示唆を与えることがいろいろあると思うのです。 |
いわゆる「理系学問」の一つの大きな目標は、宇宙や生物を含む広い意味での「自然」の原理や成り立ちを探究することです。従ってそこで得られた知見はあくまで自然に関するものですが、しかしそれが人間社会のありかたに対する示唆となる場合があるはずだ・・・・・・。そういう問題意識が『強い者は生き残れない』という本を紹介した理由でした。
全く同じ考えで、別の本の内容を紹介したいと思います。今回も生命化学の一分野ですが、免疫学に関するものです。
多田富雄氏の2つの著作
免疫学について私が過去に読んだ本のなかで印象的だったのは、免疫学者である故・多田富雄氏の、
| ◆ |
免疫の意味論(青土社 1993) | |
| ◆ |
免疫・「自己」と「非自己」の科学(NHKブックス 2001) |
という2つの著作です。

|

|
|
|
多田富雄 『免疫の意味論』 |
多田富雄 『免疫・自己と非自己の科学』 |
以下、この本の内容をもとに人間の免疫のメカニズムを概観し、そこでの知見が示唆するものを探ってみたいと思います。免疫学は日進月歩で、現在も新しい発見が続いています。その意味では「一時代前の」2冊なのですが、根幹のところは変わらないので、そこに焦点を当てます。
獲得免疫
まず人間の免疫には「自然免疫」と「獲得免疫(適応免疫)」の2系統があります。
自然免疫は一つ一つの異物(抗原)を区別しない免疫システムです。抗原とは、免疫の働きによって排除の対象となる異物を言います。
例えばインフルエンザ・ウイルスが細胞に進入し、DNAを複製して増殖を始めると、細胞はインターフェロンというウイルス抑制物質を出します。この物質は人間の体内にある各種の免疫細胞(マクロファージ、白血球、ナチュラル・キラー細胞など)を活性化させ、それらの免疫細胞はウイルスに感染した細胞を破壊したり飲み込んだりします。この段階でインフルエンザが治癒するケースもあるわけです。しかしそれを越えると「獲得免疫」の出番になる。
獲得免疫とは、ある特定の抗原に対して、それと特異的に反応するタンパク質(抗体)が体内に増え、その抗体が抗原を無力化することで体を防御する仕組みです。「特異的」というところがポイントです。
獲得免疫は自然免疫と違って「免疫の記憶」が成立します。つまり、ある抗原に対する免疫反応が起こると、次に全く同じ抗原が体内に進入した時には、極めて速やかに免疫反応が起こり、抗原を排除します。この結果、病気にならなかったり、なったとしても軽い症状で済む。麻疹(はしか)に一度かかると2度とかからないとか、ある特定タイプのインフルエンザのワクチンを接種しておくとそのインフルエンザにかからない、といった例です。ワクチンは獲得免疫を人為的に作り出す手段です。世界史においてワクチンの先駆けとなったのはもちろんジェンナーで、牛痘のワクチンを接種すると天然痘が予防できることを発見したわけですね。有名な話です。
人間の免疫システムは極めて複雑です。以降は、多田氏の著作のほとんどを占めている獲得免疫のメカニズム、その中で最も重要なT細胞とB細胞の連携プレーで実現される免疫の仕組みに絞り、概要をまとめます。自然免疫の仕組みが解明されたのは1990年代後半以降の比較的最近ですが、獲得免疫は20世紀を通じて免疫研究の中心課題でした。その成果が多田氏の本に結実しています。
免疫システムの主役・リンパ球
免疫システムは極めて多種の細胞の複雑な協調作用で実現されますが、これらの細胞はすべて骨髄の中に存在する「造血幹細胞」が分化して出来たものです。その過程が下図です。
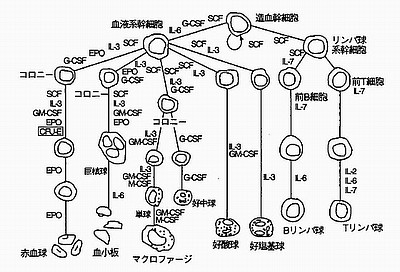
|
|
免疫・造血系細胞の発生 (『免疫・自己と非自己の科学』より) |
免疫の主役はリンパ球(T細胞やB細胞。図ではTリンパ球・Bリンパ球)やマクロファージですが、図の中には、赤血球、血小板、好中球、好塩基球、好酸球といった血液細胞も含まれています。免疫細胞と血液細胞は、元はというと同じ細胞なのです。
| リンパ球の数 |
人間のリンパ球の総数は約2兆個であり、重量にして約1kgもあります。そのうちの70%がT細胞で、残りがB細胞その他です。リンパ球は約100億個が毎日死滅し、新たに作られます。100億個といっても全体のわずか0.5%に過ぎません。しかし1日に100億個ということは1秒間ではリンパ球の100万個が入れ替わる計算になるのです。免疫を知るには、まずこの想像し難いような「量の多さ」を念頭に置いておくべきでしょう。
| サイトカイン |
図の線のところに書き込まれている英字略字は「サイトカイン」を示します。サイトカインとは、細胞が作りだし、細胞間の情報伝達や細胞の活性化・不活性化などの指令に使われるタンパク質の総称です。似た働きをするものにホルモンがありますが、ホルモンは遠隔の細胞まで効果が及ぶのに対し、サイトカインの情報伝達が及ぶのは近接した周辺の細胞という違いがあります。
造血幹細胞が免疫細胞と血液細胞に分化していく過程では、その場でどういうサイトカインが働くかによって細胞が複雑に分化し、免疫システム全体ができあがっていく仕組みになっています。
自己と非自己
多田氏の本で何回か強調されていることですが、
| 免疫は自己と非自己(異物としての抗原)を認識し、非自己を排除することによって自己の統一性を保ち、生命を維持するしくみ |
です。非自己とは「免疫系を刺激し、免疫反応を起こす物質や生物すべて」であり、一般的には細菌やウイルス、タンパク質や多糖類(デンプン、セルロース、グリコーゲンなどの高分子の類)です。化学物質も人間のタンパク質と結びつくことによって抗原となる場合があります。
免疫システムは極めて困難なことを実現しようとするものです。その「困難さ」は以下の3点に集約されるでしょう。
| 自己とは何か |
まず「非自己を排除し、自己を守る」といっても、その「自己」は決して固定的なものではなく、変化していきます。
たとえば幼児期には作らず、成熟して初めて人間の体内で作られるホルモンがあります。これを「非自己」として排除してしまっては人体が成り立ちません。母乳には母乳にしか含まれないタンパク質があります。あたりまえですが母親の免疫システムは(もちろん新生児も)これを「非自己」として排除することはありません。変化に対応できる何らかの「自己」認識の仕組みがあるのです。
| 非自己は無限 |
第2の「困難なこと」は「非自己」の種類は無限に考えられることです。何が来るか分からない。何が来るか分からないけれど、誤って「非自己」を「自己」と認識してしまい、それがたまたま悪性のウイルスだったりすると致命的になる。
不思議なのは、無限にあるはずの非自己=抗原に対し、抗原ごとに特異的に反応する抗体ができ、それが抗原を無力化するという「獲得免疫」のメカニズムです。どうしてこんなことが可能なのか。免疫システムの根幹のところです。
| ウイルスの存在 |
第3の「困難なこと」はウイルスの存在です。ウイルスはもちろん非自己として排除すべきものですが、ウイルスは人間の細胞内に進入し、もともとある細胞のDNAを利用してウイルスのDNAを複製し、そこから新たなウイルスを増殖させて細胞外に飛び出します。人間の細胞の内部、DNAの一部にウイルスのDNAが組み込まれている状態は自己なのか非自己なのか。「自己の中に非自己が潜んでいる状態」と言わざるを得ないでしょう。人間の免疫システムは、これを検知し排除する必要があります。
「自己」は変化し「非自己」のバリエーションは無限です。ウイルスというやっかいな「非自己」もある。免疫は「極めて困難なこと」に立ち向かっていることは確かでしょう。多田氏の著作に「困難なこと」いう表現はありませんが、明らかにそう見えます。「自己と非自己を認識し、非自己を排除する」ための免疫システムは、その仕組みが大変複雑なものであることが直感できます。
自己の標識:MHC
その守るべき「自己」を、免疫システムはどうやって判断しているのでしょうか。その判断の根拠となるのが、MHCと呼ばれる「標識」です。
| MHC |
生物は細胞の表面に「主要組織適合遺伝子複合体。Major Histocompatibility Complex。MHC」と呼ばれるタンパク質を持っています。ヒトの場合、HLAと呼ばれます。これが個人ごとに(もちろん生物種ごとに)全部違い、これが「自己」の標識となっているのです。
ヒトのMHCの形は第6染色体に並んでいる6種の遺伝子で決まります(この遺伝子群もMHCと呼ばれる)。従ってヒトは親から合計12個の遺伝子を受け継ぎ、そのうちの6個でMHCの型(タンパク質分子の形)が決まる。しかも6種の遺伝子それぞれはアミノ酸の入れ替えで「多型」になっています。つまり個人ごとの遺伝子変異が多数あるのです。
これらのことから、一人のMHCの型が他人の型と全く一致することはほとんどありません。ヒトは約60兆個の細胞がありますが、このすべての細胞の表面に数万~数10万のMHCがあります。これらが自己の標識となっていて、免疫システムはこのMHCをたよりに「自己」を見分け「非自己」を排除するのです。まず厳格な自己認識システムがあり、それを利用して自己と認識できないものを非自己と認識する。ここが仕組みの根幹です。
臓器移植が難しい理由は、人間に備わったこの自己認識システムです。生体肝移植にしろ、心臓移植にしろ、強力な免疫抑制剤を使わないと移植は成功しない。免疫抑制剤を使ったとしても、他人の皮膚の移植などは今だに成功しません。人間の免疫の仕組みが極めて鋭敏に他人の細胞を見分け、それを排除しにかかるからです。他人の細胞ではあるものの、同じ人間としての遺伝子をもつ細胞です。同じ機能・役割を果たす細胞であり(MHCさえなければ)全く同じ細胞と言っていい。それが排除されるのです。
|
ノーベル賞を受賞した京都大学・山中教授のiPS細胞が画期的な理由の一つは、まさにこのMHCによる自己認識の仕組みだ、との言い方ができるでしょう。神経や臓器の細胞の損傷・劣化・機能不全・死滅に起因する病気はたくさんあります。自分の皮膚の細胞からiPS細胞を作り、そこから損傷・死滅した細胞に分化・増殖させることが出来たら・・・・・・。遺伝的に全く同じ細胞、つまりMHCまで同じ細胞なので、自己の免疫系が排除することはありません。医療に革新が起こるに違いない・・・・・・。誰しもそう考えるのですね。「移植」と「再生」。この差は限りなく大きい。その差を作り出しているのがMHCなのです。 MHCによる自己と非自己の認識の仕組みで思うのは「ここまでやる必要があるのか」という感じです。何となく「やりすぎ」の感がある。生物の種ごとにMHCの形が決まっていて「人間同士の臓器移植はできるが、種を越えた移植はできない」ぐらいで十分な感じもします。 MHCによる自己認識方式だと、胎児は母親にとって完全な異物になります。胎児は両親のMHC遺伝子を受け継いでいて、母親と胎児のMHCの型は違うからです。胎児は非自己の最たるものであり、母親の免疫系の攻撃対象になって当然なのです。 しかしそれではまずい。多田氏の本によると母親と胎児をつないでいる胎盤の細胞表面からはMHCが消え、免疫系が認識できない分子が現れるというような仕組みがあるらしい。それで胎児は母親の免疫システムの攻撃をまぬがれているようです(他にも仕組みがある)。そうでもしないと種は維持できません。免疫システムは「やりすぎ」と感じるぐらい極めて鋭敏かつ非寛容であり、その結果として胎児の保護のためには特殊な仕掛けが用意されているのです。 しかし多田氏の本の全体を読むと、この「やりすぎ」には重要な意味があることがよく分かります。それは人間という種の維持にとって必須です。後で振り返ります。 |
| MHC・ペプチド複合体による自己認識 |
免疫システムにおける「自己」「非自己」の認識は、単にMHCの相違を見分けるだけでなく、もっと複雑です。
下図にMHC分子の立体構造の模式図を掲げました。左が「横から見た図」、右が「上から見た図」です。「横から見た図」においては下の方が細胞膜に接している部分、上が細胞膜から離れている方向です。
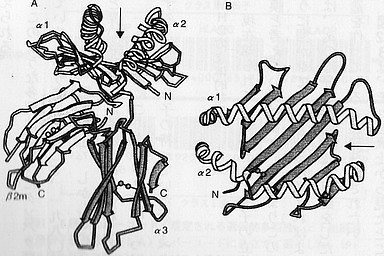
|
|
MHC(クラス1)分子の立体構造 (『免疫・自己と非自己の科学』より) |
よく見ると2つの螺旋構造が目につきます。かつ、2つの螺旋は「向かい合って」いて、その間には「溝」があるような構造になっている(図の矢印のところ)。タンパク質化学では螺旋状のポリペプチド(アミノ酸の連鎖分子)を「アルファ・へリックス」と呼ぶそうですが、アルファ・へリックスは構成するアミノ酸の並びが少し変化しても螺旋の「巻き方」がガラッと変わることが知られています。ということは、MHCがヒトによって違うことを考えると、溝の形もヒトによって違うことになります。
実はこの「溝」には必ず「自己」ないしは「非自己」に由来するタンパク質の断片(=ペプチド)がはさまっているのです。「はさまっている」ペプチドは、必ず9個のアミノ酸から成ります。この「MHC・ペプチド複合体」をもとに免疫システムは「自己」と「非自己」を識別するのです。ペプチドが「溝」にはさまっている状態を「提示されている」と言います。
MHCには実は2種類あります。クラス1・MHCとクラス2・MHCの2種類で、少し形が違いますが、似たような構造をしています。
クラス1・MHCはすべての細胞の表面にあり、提示されているペプチドはその細胞内部で作られたタンパク質の断片です。
クラス2・MHCは、主にAPC(Antigen Presenting Cell。抗原提示細胞。後述)と総称される細胞の表面にあり、提示されているペプチドは、APCが細胞外部からタンパク質を取り込み、断片にしたものです。
もし人間の体内に「非自己」が一切ないとすると、クラス1・MHCもクラス2・MHCも、提示しているのは自己由来のペプチドです。しかしウイルスが細胞内に進入して細胞のDNAを利用してウイルスのタンパク質を合成し始めると、その細胞のクラス1・MHCに提示されるペプチドにはウイルス・タンパク質由来のペプチドが含まれることになります。また何らかの「非自己」が人間の体内に進入すると、APCがもつクラス2・MHCに提示されるのはその非自己由来のペプチドが含まれることになります。
この「MHC・ペプチド複合体」が自己と非自己の判別基準になっているのです。
T細胞
「MHC・ペプチド複合体」によって自己と非自己を判別し、非自己を体内から排除する・・・・・・。この判別を行っているのがT細胞です。T細胞は2兆個あるリンパ球の70%を占める免疫システムの主役です。
「免疫システムの主役・リンパ球」のところで書いたように、すべての血液・免疫細胞は骨髄で作られる造血幹細胞が分化してできたものです。造血幹細胞が「胸腺」に取り込まれると、そこで分裂・増殖を繰り返して、大量のT細胞に分化します。T細胞のTとは胸腺(Thymus)のTです。
人間の胸腺は、心臓の周りの脂肪組織の中にある小さな臓器で、10代で最大の大きさになり、約35グラムです。その後次第に萎縮し、40代では10グラム以下になります。胸腺の萎縮は老化と深い関係があります。
T細胞はTCR(T Cell Antigen Receptor。T細胞抗原受容体)というタンパク質の構造体を細胞表面に持ちます(下図の左)。このTCRが「非自己」を提示しているMHCを認識するのです。つまり、T細胞が抗原と反応したということになります。
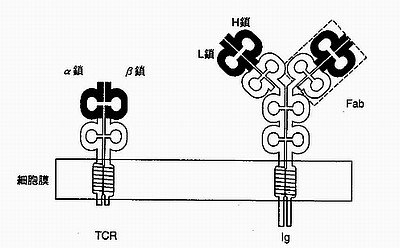
|
|
TCR(左)と抗体(Ig。右)の模式図 長方形は細胞膜で、下が細胞内。 α・β鎖(TCR)、H鎖・L鎖(Ig)が可変部であり、 遺伝子組換えで形成される。TCRとIgは良く似ている。 (『免疫・自己と非自己の科学』より) |
TCRは、胸腺で造血幹細胞がT細胞に分化するときに遺伝子再構成(=遺伝子の断片がランダム組み合わされて、多様なタンパク質の構成を作り出す仕組み)が起こり、無限とも思えるバリエーションが作り出されます。図のα鎖・β鎖のところです。どんな抗原と反応するTCRができるかは予想できません。従って自己由来のペプチドを提示しているMHCと反応してしまうTCRもできてしまうわけです。
しかし胸腺の中で、自己のMHCと強く反応するT細胞は死滅してしまいます。またMHCと全く反応しないものも死滅する。前者は自己を攻撃する危険なT細胞、後者は免疫システムとしては役にたたないT細胞というわけです。「生き残る」のは、分化したT細胞の5%以下と言います。要するにランダムに作ったものから「あぶない」ものと「役にたたない」ものを排除する。この仕組みが獲得免疫を成立させる根幹のところにあるわけです。
生き残ったT細胞はさらに分化します。そのうち、
◆ヘルパーT細胞
◆キラーT細胞
が代表的ものであり、胸腺から出ていって免疫細胞としての役割を担うことになります。
| ヘルパーT細胞 |
ヘルパーT細胞は免疫システムにおける司令塔です。ヘルパーT細胞は表面のTCRを用い、APCが提示している「クラス2・MHCと抗原由来のペプチドとの複合体」を認識すると、増殖を始めます。そしてサイトカインを合成し放出します。このサイトカインはキラーT細胞やB細胞を活性化し、抗原に対する「総攻撃」が始まることになります。
AIDSウイルスはこのヘルパーT細胞を特異的に狙うウイルスです。AIDSウイルスに感染するとヘルパーT細胞が次第に減少し、免疫システムは破綻に向かいます。そして通常なら全く問題ないような病原菌が体内で繁殖し、人間を死に追いやるのです。
| キラーT細胞 |
キラーT細胞はヘルパーT細胞からのサイトカインを受け取ると活性化され、大増殖を始めます。そして抗原の断片を提示しているクラス1・MHCをキラーT細胞の表面のTCRで認識すると、その細胞を殺します。キラーT細胞はヘルパーT細胞と違い、直接に抗原を提示している細胞を殺すT細胞です。
インフルエンザの場合、キラーT細胞が働き出すのは感染から4~5日です(同じタイプのインフルエンザに感染した経験がない場合)。
B細胞と抗体
B細胞は抗体(免疫グロブリン。Igと略称される。上図の右)を合成する能力をもった細胞です。B細胞はIgというタンパク質を細胞の表面に持っています。Igは特定の抗原と特異的かつ直接的に結合し、その抗原を無力化します。IgはB細胞から遊離して体内の循環系の中にあっても、抗原との結合能力を発揮します。
B細胞はヘルパーT細胞からのサイトカインを受け取ると活性化し、分裂しはじめます。さらにB細胞はヘルパーT細胞からの別のサイトカインによってプラズマ細胞に分化します。プラズマ細胞は大量の抗体を生産・分泌する能力があり、この抗体の効果で病気は終息に向かうことになります。
プラズマ細胞による抗体が生産されるのは、インフルエンザの場合、感染から7~8日(同じタイプのインフルエンザに感染していない場合)。
しかしながら増殖したB細胞のすべてがプラズマ細胞に分化するわけではありません。一部は「記憶B細胞」として長く体内に残ります。しかも記憶B細胞においては、Igがより抗体との反応性が高いタイプにに変化します。これが「獲得免疫」であり、次に同じ抗原が体内に進入したときにはこのB細胞の抗体が働くことになります。また増殖したT細胞も体内に残り、これも獲得免疫に寄与します。
| 免疫グロブリン(Ig)の多様性 |
免疫グロブリン(Ig)は特定の抗原に対して特異的に働きます。したがってB細胞ごとにIgの形は違っていて「無限の」多様性があるわけです。この免疫グロブリンはV領域(H鎖・L鎖の部分。=可変部)と、それ以外のC領域(=定常部)にわかれています(上図の右)。
V領域は対応する抗原ごとに違い、極めてバリエーションに富む部分です。この多様性はT細胞のTCRの多様性と同じようにランダムな「遺伝子組み替え」で実現されます。計算上、10の12乗(1兆)のバリエーションが可能と言います。これを発見したのが、1987年にノーベル賞(生理学・医学賞)を単独受賞した利根川進博士です。
| ちなみに第二次大戦後のノーべル生理学・医学賞をみると、単独受賞は67回のうち11回しかありません。また理系の3賞(物理学、化学、生理学・医学)の日本人受賞者・16人(2012年現在)のうち、単独受賞したのは湯川秀樹博士と利根川博士の2人だけです。利根川博士の業績が突出していたということでしょう。 |
一方、C領域は免疫グロブリンの種類(=クラス)を決めます。詳細は割愛しますが、IgMよりもIgG、IgE、IgAが抗原との反応性が高いタイプです。
Igがランダムに作られるということは、TCRと全く同じ理屈で、自己のタンパク質と反応するIgもできてしまうわけです。B細胞は骨髄の中で造血幹細胞から分化してできますが、分化の課程で自己と反応するB細胞は死滅します。しかし胸腺のような特別な「教育機関」があるわけではないので、自己反応性のB細胞も生き残りやすいようです。従って組織の末梢において、自己と反応するB細胞が死滅したり抗原と無反応になるような仕組みがあるのですが、これは省略します。
| APC:抗原提示細胞 |
B細胞で重要なことは、B細胞は抗原提示細胞でもある、ということです。抗原提示細胞(Antigen Presenting Cell。APC)とは
| ① | 抗原を細胞に取り込む。 | |
| ② | 抗原をタンパク質の断片(ペプチド)に分解する。 | |
| ③ | ペプチドを細胞表面のクラス2・MHCの「溝」に提示する。 |
という作用をもった細胞です。人間の体内では、マクロファージ、B細胞、樹状細胞(以上、組織内)、白血球、単球(血液中)などがAPCです。
免疫のプロセス
以上を踏まえて、免疫のプロセスがどう働くのか、そして免疫の記憶がどのように成立するのかを多田氏の文章から引用してみたいと思います。今までの紹介は以下の文章を理解するための「予備知識」とも言えます。B細胞が抗原提示細胞(APC)の役割もする場合の説明です。
|
ちなみに、免疫グロブリンC遺伝子とは、免疫グロブリンの定常部(=C領域)を決定する遺伝子、V遺伝子とはV領域(H鎖・L鎖の部分。可変部)を決める遺伝子です。
免疫的寛容
以上の説明は免疫の仕組みのごく一部であり、実際はもっと複雑で多種の免疫細胞がからみます。さらに抗原が入ってくると必ず上記のような免疫反応が起きるかというと、そうでもないのです。抗原に免疫システムが反応を示さないこともある。これを免疫的「寛容」と言います。
ある特定の抗原に何回もさらされると、その抗原に対して寛容になる場合があります。また経口的に入った抗原に対しては寛容になる。
たとえば卵を食べたとき、卵白のタンパク質であるアルブミンは腸で完全にアミノ酸に分解されるわけではなく、一部は血液中に入ります。その血液中に入る量は、もし注射をしたとしたら間違いなくアナフィラキシー・ショック(全身に起こる急性の免疫過剰反応。命にかかわることがある)を起こす量です。しかしアルブミンという非自己であっても経口的に摂取されると、免疫は寛容になる。
さらに「自己と反応してしまう免疫細胞の存在」があります。B細胞では自己と反応する抗体を持つものが骨髄から抜けだして体内に送られることがあると、先ほど書きました。T細胞でさえ胸腺でのチェックをすり抜けて体内に送られる「自己反応性のT細胞」がある。しかしこれらがすぐに問題を起こすわけではありません。免疫反応を起こすには上に書いた以外にも条件があり、自己反応性のB細胞・T細胞であっても「自己に対しては寛容になる」しかけがあるのです。
(続く)
| 補記1 |
「免疫細胞が自己を攻撃しない」ことの出発点は「自己を攻撃する免疫細胞は胸腺で除かれる」ことでした。多田氏の本が書かれた時代には、その詳しい仕組みは不明でしたが、最近、その一端が解明されはじめたようです。それを報じた新聞記事を引用します。
|
この記事を書いた記者の新井氏は医学関係にかなり詳しいようで、専門用語がポンポン飛び出す記事になっています。しかしその内容は、東大の高柳教授の発見の「意味」を的確に解説した良い記事だと思います。この記事を読んで非常に意外だったのは、下線をつけたところです。つまり、
| Fezf2 が作るたんぱく質は、遺伝子の働きを制御する「転写因子」のひとつで、胸腺細胞で様々な遺伝子のスイッチを入れ、体の各所にあるたんぱく質を合成する |
のところです。普通、学校では次のように習います。
| ◆ | 人間の体は約60兆の細胞でできている。 | ||
| ◆ | すべての細胞には同じ遺伝子(DNA)がある。 | ||
| ◆ | 体の部位によってどの遺伝子が発現するかが決まる。この発現を制御する仕組みがある。 | ||
| ◆ | この仕組みで、筋肉や心臓や皮膚などの多様な臓器や体が出来上がり、維持される。 |
しかし記事によると、胸腺だけは違うのですね。胸腺では、体にあるすべてのたんぱく質が次々と作られる仕組みがあるようなのです。
「攻撃を担う多種多様なT細胞がランダムに作られる」と記事にあるように、非自己を攻撃できるT細胞の能力の源泉は「ランダム」というところにあります。この仕組みを解明したのが、ノーベル医学・生理学賞を単独受賞した利根川進博士であることは本文中に書きました。
ランダムに作られたT細胞の中には、当然、自己を攻撃するものがある。これを排除する仕組みで唯一ありうるのは、T細胞が「標的」を攻撃するかどうかで判断するしかない。その「標的」とは「自己に存在するたんぱく質のすべて」でしかありえない・・・・・・。「どの方向に弾が飛ぶかは決まっているが、飛ぶ方向は全く不明な銃」を作ったとしたら、それは危なくて出荷できません。弾が前に飛ぶことを確認する唯一の手段は、実際に撃ってみることである・・・・・・。よくよく考えてみると、極めてロジカルです。
その論理的には予想できることが、実際の生体の中でどう行われているのか、その仕組みを解明する糸口が見えて来たわけです。高柳教授の発見の意義は記事に書かれている通りです。今後の研究に期待したいと思います。
(2015.11.20)
| 補記2 |
自己を攻撃する危険なT細胞を取り除く胸腺の機構は、完全ではありません。除去に失敗して胸腺の外へ出る危険なT細胞があります。しかしそれを除く別のしくみがあります。その一端が解明されたという報道がありました。それを引用したいと思います。
|
ちなみに記事での「関節炎リウマチ」は、普通は「関節リウマチ」と言うと思います。関節炎には様々な原因があり、その一つが関節リウマチです。
「自己を攻撃する危険なT細胞が胸腺で取り除かれる」というのは、1990年代半ばに判明したことだと記憶しますが、それから20年以上が経過しています。免疫のしくみの解明は今後も続くのでしょう。
(2019.4.12)
2012-11-16 20:16
nice!(0)
トラックバック(0)



