No.337 - がんは裏切る細胞である [科学]
前回の No.336「ヒトはなぜ "がん" になるのか」は、英国のサイエンスライター、キャット・アーニー著の同名の本を紹介したものでした。内容は、がんを「体内で起きる細胞の進化」ととらえ、その視点で新たな治療戦略の必要性を説いたものでした。
今回は引き続き同じテーマの本を紹介します。アシーナ・アクティピス著「がんは裏切る細胞である ─ 進化生物学から治療戦略へ ─」(梶山あゆみ・訳。みすず書房 2021。以下 "本書")です(原題は "The Cheating Cell")。
前回の本と本書は、2021年の出版です。つまり「進化生物学の視点でがんの生態を研究し治療戦略をつくる」という同じテーマの本が、同じ年に2冊刊行されたことになります。ただし、今回の著者は現役のがん研究者で、そこが違います。
著者のアシーナ・アクティピス(Athena Aktipis)は米国のアリゾナ州立大学助教で、同大学の "進化・医学センター" に所属しています。またカリフォルニア大学サンフランシスコ校の進化・がん研究センターの設立者の一人です。進化生物学の観点からがんを研究する中心の一人といってよいでしょう。従って、自身や仲間の研究も盛り込まれ、また、がんの生態に関する詳細な記述もあります。専門的な内容も含みますが、あくまで一般読者を対象にした本です。専門性と一般性がうまくミックスされた好著だと思いました。
以下、本書の内容の "さわり" を紹介します。以降の本書からの引用は、原則として漢数字を算用数字に直し、段落を追加したところがあります。また、下線や太字は引用をする上でつけたもので原文にはありません。
がんと進化:2つの視点
本書の最初の4つの章は、
と題されています。この4つの章の内容をごく短く要約すると、
となるでしょう。まず、ここまでの内容を本書からの引用を含めて紹介します。
がんを「進化のプロセス」としてとらえるとき、その "進化" には2つの視点があります。一つは「体細胞の進化 = がん」です。2つ目は、体細胞が「生物」を構成している、その「生物の進化」です。がんを考えるとき、この2つの視点で見ることが重要です。
がんという "体細胞進化" は、ヒトを含む生物の一生のうちに起こるものですが、がんを押さえ込むしくみは生命の長い歴史の中で "進化" してきたものです。2つの時間軸は全く違います。この違いを理解しておく必要があります。
がんを「体細胞の進化」ととらえるとき、その進化は生物を死に至らせる(ことがある)わけです。このような状況を「進化」と呼んでよいのでしょうか。著者は、それも進化のうちだと、「進化的自殺」という言葉を使って次のように述べています。
"進化" は "変化" であって、"良くなる" ことではありません。進化の袋小路に入り込んで、結果として環境変化についていけずに絶滅するようなことも起きる。これも進化です。
多細胞ルールブック
がんとは何かを知るためには、多細胞生物の "細胞レベルでの基本的な振る舞い" を理解する必要があります。多細胞生物は、膨大な数の細胞同士が、ルールにのっとって協力することで成り立っています。このルールを著者は「多細胞ルールブック」と表現しています。そのルールブックに記されている重要点は、次の5つです。
この "多細胞ルール" のどれか、あるいは全部を破る細胞が、がん細胞です。その発端は遺伝子の変異です。一般的に遺伝子が変異した細胞は死滅することが多く、また生存・死滅にかかわらない中立的な変異も多い。しかし(たまたま)多細胞ルールを破る細胞が現れ、それがその時の体内環境によって「選択」されることが起こります。
ここで述べられているように、多細胞ルールブックに反する遺伝子変異が、その細胞の生き残りと増殖にとって有利になる場合があります。たとえば、増殖の抑制が利かない、アポトーシス(=細胞の自死)が起きない、代謝異常のため資源を浪費する、といった変異です。またがんを抑制する遺伝子の変異もルール破りにつながる。
生物の集団全体でみると、多細胞ルールブックどおりに行動する《協力者細胞》の多い生物の方が、より長く生きて多くの子孫を残します。しかし局所的に見ると、自然選択が《裏切り者細胞》に有利に働くことがあるのです。
がん抑制のメカニズム
「進化」を「体細胞進化」と「生物進化」の2つのマルチレベルでとらえると、「生物進化」のレベルにおいて、生物は「がん抑制のメカニズム」を発達させてきました。著者はそれを「細胞の良心」「ご近所の目」「体内の警察隊」の3つのカテゴリーで説明しています。
まず細胞内には、自身のがん化の兆候を認識し、しかるべき対応をとるように伝達する遺伝子の情報ネットワークが存在します。その代表が、TP53 という遺伝子(=がん抑制遺伝子)を中心とするネットワークです。
次は近接した細胞同士が互いに監視しあい、周囲の細胞とは違う異常行動をする細胞を排除する仕組みです。
そして最後は免疫システムです。免疫はがん特有の抗原を感知し、その抗原を発現しているがん細胞を排除することができます。
トレードオフ
以上のような「がん抑制メカニズム」があるにもかかわらず、なぜ、がんが発生するのでしょうか。生物レベルの進化の過程で「がんは完全に抑制できる」ようにならなかったのでしょうか。
その理由は、ヒトの(生物の)胎内から墓場まで、数々の場面で細胞が "がんのように振る舞う" 必要があるからです。つまり「がん抑制メカニズムを強くしすぎると、正常に生きていくことに支障をきたす」という "トレードオフ" の関係があるのです。
細胞が急激に増殖したり、細胞が移動したりするといった振る舞いは、胚の発達過程からはじまって生体の傷の修復まで、数々のシチュエーションで必要になります。しかしこのような振る舞いは、まさにがん細胞が得意とするものなのです。
がん抑制遺伝子であるTP53が過敏だと細胞の早期老化につながったり、炎症が過度に引き起こされることが分かっています。つまり、細胞を自由にさせ過ぎるとがんのリスクが高まるが、逆に細胞の自由度を抑制し過ぎれば、成長が止まったり生殖に失敗する恐れが出てくるのです。本書の第4章、「がんは胎内から墓場まで」では、こういった "トレードオフ" の例が詳細に語られています。
本書の第5章は「がんはあらゆる多細胞生物に」と題されていて、植物を含む多細胞生物全般に "がん類似の" 異常増殖が見られることが説明されています。
さらに第6章「がん細胞の知られざる生活」では、がんが体内でどのように進化し、生息し、転移するのかが、研究者の立場から詳細に述べられています。
がんをいかにコントロールするか
第7章(最終章)は「がんをいかにコントロールするか」と題されていて、今後のがん治療に必要な視点が述べられています。
「がん = 進化しつつある体内微小環境」であり、がん組織は治療(抗がん剤、放射線など)への抵抗性があるように進化します。治療により一時的に多くのがん細胞が死滅したとしても、そのあとに残った抵抗性のあるがん細胞が一挙に増大して、結果として手が着けられなくなることが多々あります。
がんは「本質的に体の一部」です。従ってそれを「攻撃する」とか「根絶やしにする」といった考え方はまずいのです。
「実際にはもっと攻撃性の低い治療法が存在するのに、それを軽視するか完全に無視してしまうかするおそれがある」と著者が書いているのは、「攻撃性の低い治療法の方が、結果として患者を延命させる効果が高い、ないしは治癒させる確率が高い」ことが十分に考えられるからです。医学界には「攻撃性が弱い」という理由で使われなくなった抗がん剤がいろいろありそうです。
では「がん = 進化しつつある体内微小環境」という視点にたつと、どのような治療方法が考えられるのでしょうか。そのヒントは「総合的病害虫管理」にあります。病害虫が農薬に対する耐性をつけることは常識化していますが、そのことを前提にしたのが総合的病害虫管理です。
ポイントは引用の最後にある「病害虫を根絶やしにするのではなく、長期的な個体数管理ができるようにする」というところです。この考え方をがん治療に応用できないか。
それを始めたのが、米国の腫瘍学者、ロバート・ゲイトンビーです。彼の治療は「適応療法」と呼ばれています。
本書ではゲイトンビーの「適応療法」のやり方が詳細に述べられています。
引用の最後のパラグラフにあるように、「遺伝的に均一な細胞で構成されている早期に発見された腫瘍」の場合は、高用量の抗がん剤で完治できる可能性があるわけです。適用療法はあくまで腫瘍組織の精密な検査とセットで行うものです。
ゲイトンビーは数々の動物実験をしたあと、2016年に患者に対する臨床試験を始めました。
がんが「体細胞の進化」であるという視点にたつと、適応療法以外にも治療のアイデアが浮かびます。その一つが「おとり薬」です。
この「おとり薬」は、上の引用にあるように試験管レベルの研究ですが、こういう発想がでてくるのも「体細胞の進化」という視点でがんを見ているからです。次の「腫瘍に資源を与える」も、根本の見方は同じです。
本書に「細胞版共有地の悲劇」という話が出てきます。「共有地の悲劇」とは、共有の牧草地で各人が銘々勝手に放牧すると草が食べ尽くされて共倒れに陥るという寓話です。
がん組織が組織周辺の資源を消費し尽くしたら「共有地の悲劇」が起こり、がん細胞は全滅します(資源不足、老廃物を解毒できない、など)。がんがこれを逃れるように進化するには、
ですが、このように進化するとまずい事態になります。そうなるよりも、がんに資源を与える方がよい。そういう考え方です。
体本来の機能によるコントロール
進化の視点からがんのコントロールを考えるとき、適応療法以外にもう一つ重要なポイントがあります。生物が進化の過程で得た「がんを抑制するメカニズム」を使う、つまり体本来の機能を使うことです。
がん細胞は、ヒトが本来もっている「がんを抑制するメカニズム」から逃れるための仕掛けを使います。この仕掛けを無効にするような治療です。一つの方法は、がん抑制遺伝子(TP53など)が変異しているとき、その機能を回復することです。これは研究段階にあります。さらに本書では「ご近所の目 = 地区レベルの監視システム」と「体内の警察隊 = 免疫」の活用があげられています。
この引用部分から類推できることは、がん細胞が出す "傷を治癒するという偽のシグナル" をブロックできれば、周囲の細胞の監視によってがん細胞を排除できる可能性があるわけです(可能性の一例ですが)。こういったタイプのがん治療は、今後の研究に負うところが多いようです。
2つ目は「体内の警察隊 = 免疫」の活用で、こちらの方は既に実用化されています。
「免疫チェックポイント阻害療法」は、本庶佑先生が開発の道を開かれたものです。先生が2018年のノーベル医学生理学賞を受賞されたのは、これが画期的だと認められたからでしょう。
未来へ向けて
がんは "やっかいなルームメイト" であり、我々はこのルームメイトと一緒に暮らしていくしかありません。目標とすべきは、
ことです。著者は本書の最後の方で次のように述べています。
最後に、著者が書いているギリシャ神話の神の話を紹介します。ギリシャ神話に登場する戦いの神、アレスとアテナの対照的な戦い方です。
戦いの神・アレス(アーレス)は男性神で、ローマ神話ではマルスです。一方、アテナは女性神で、古代ギリシャの中心都市、アテネ(アテナイ)の守護神です。
著者は子供の頃をアテネで暮らしたギリシャ系アメリカ人です。祖母はアテナという名前で、彼女の名前は祖母の名からとったものです。そのアテナの英語読みがアシーナ(Athena)です。著者は、未来に向けたがん治療のあり方を、自らの名前の由来になったギリシャ神話の神・アテナの戦い方になぞらえているのでした。
今回は引き続き同じテーマの本を紹介します。アシーナ・アクティピス著「がんは裏切る細胞である ─ 進化生物学から治療戦略へ ─」(梶山あゆみ・訳。みすず書房 2021。以下 "本書")です(原題は "The Cheating Cell")。
著者のアシーナ・アクティピス(Athena Aktipis)は米国のアリゾナ州立大学助教で、同大学の "進化・医学センター" に所属しています。またカリフォルニア大学サンフランシスコ校の進化・がん研究センターの設立者の一人です。進化生物学の観点からがんを研究する中心の一人といってよいでしょう。従って、自身や仲間の研究も盛り込まれ、また、がんの生態に関する詳細な記述もあります。専門的な内容も含みますが、あくまで一般読者を対象にした本です。専門性と一般性がうまくミックスされた好著だと思いました。
以下、本書の内容の "さわり" を紹介します。以降の本書からの引用は、原則として漢数字を算用数字に直し、段落を追加したところがあります。また、下線や太字は引用をする上でつけたもので原文にはありません。
がんと進化:2つの視点
本書の最初の4つの章は、
| 第1章 はじめに | |
| 第2章 がんはなぜ進化するのか | |
| 第3章 細胞同士の協力を裏切る | |
| 第4章 がんは胎内から墓場まで |
と題されています。この4つの章の内容をごく短く要約すると、
| がんは、多細胞生物の体内で起こる細胞レベルの進化である。 | |
| 一方、生物のレベルでは、がんを抑制するしくみが進化してきた。 | |
| "がんの進化" とそれを "抑制するしくみ" の2つは、胎内から墓場までのあいだ、体の中で攻めぎ合っている。 |
となるでしょう。まず、ここまでの内容を本書からの引用を含めて紹介します。
がんを「進化のプロセス」としてとらえるとき、その "進化" には2つの視点があります。一つは「体細胞の進化 = がん」です。2つ目は、体細胞が「生物」を構成している、その「生物の進化」です。がんを考えるとき、この2つの視点で見ることが重要です。
|
がんという "体細胞進化" は、ヒトを含む生物の一生のうちに起こるものですが、がんを押さえ込むしくみは生命の長い歴史の中で "進化" してきたものです。2つの時間軸は全く違います。この違いを理解しておく必要があります。
|
がんを「体細胞の進化」ととらえるとき、その進化は生物を死に至らせる(ことがある)わけです。このような状況を「進化」と呼んでよいのでしょうか。著者は、それも進化のうちだと、「進化的自殺」という言葉を使って次のように述べています。
|
"進化" は "変化" であって、"良くなる" ことではありません。進化の袋小路に入り込んで、結果として環境変化についていけずに絶滅するようなことも起きる。これも進化です。
多細胞ルールブック
がんとは何かを知るためには、多細胞生物の "細胞レベルでの基本的な振る舞い" を理解する必要があります。多細胞生物は、膨大な数の細胞同士が、ルールにのっとって協力することで成り立っています。このルールを著者は「多細胞ルールブック」と表現しています。そのルールブックに記されている重要点は、次の5つです。
|
この "多細胞ルール" のどれか、あるいは全部を破る細胞が、がん細胞です。その発端は遺伝子の変異です。一般的に遺伝子が変異した細胞は死滅することが多く、また生存・死滅にかかわらない中立的な変異も多い。しかし(たまたま)多細胞ルールを破る細胞が現れ、それがその時の体内環境によって「選択」されることが起こります。
|
ここで述べられているように、多細胞ルールブックに反する遺伝子変異が、その細胞の生き残りと増殖にとって有利になる場合があります。たとえば、増殖の抑制が利かない、アポトーシス(=細胞の自死)が起きない、代謝異常のため資源を浪費する、といった変異です。またがんを抑制する遺伝子の変異もルール破りにつながる。
生物の集団全体でみると、多細胞ルールブックどおりに行動する《協力者細胞》の多い生物の方が、より長く生きて多くの子孫を残します。しかし局所的に見ると、自然選択が《裏切り者細胞》に有利に働くことがあるのです。
がん抑制のメカニズム
「進化」を「体細胞進化」と「生物進化」の2つのマルチレベルでとらえると、「生物進化」のレベルにおいて、生物は「がん抑制のメカニズム」を発達させてきました。著者はそれを「細胞の良心」「ご近所の目」「体内の警察隊」の3つのカテゴリーで説明しています。
| 細胞の良心 |
まず細胞内には、自身のがん化の兆候を認識し、しかるべき対応をとるように伝達する遺伝子の情報ネットワークが存在します。その代表が、TP53 という遺伝子(=がん抑制遺伝子)を中心とするネットワークです。
|
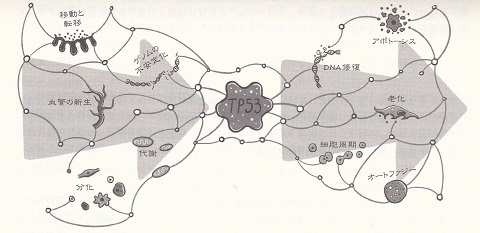
|
TP53 の遺伝子ネットワーク |
がん抑制遺伝子TP53は遺伝子ネットワークの中心的な中継点であり、特定の細胞が生物の生存能力を脅かすかどうかを「判断」している。p53タンパク質を製造することにより、細胞機能の様々な側面から情報を集め、細胞の裏切り(代謝の異常,ゲノムの不安定化、不適切な移動など)の徴候が確認されたら細胞周期を停止したり、DNAを修復したり、必要であればアポトーシス(細胞の自死)を誘導したりもする。本書 p.57 の図3-3 より引用。 |
| ご近所の目 |
次は近接した細胞同士が互いに監視しあい、周囲の細胞とは違う異常行動をする細胞を排除する仕組みです。
|
| 体内の警察隊 |
そして最後は免疫システムです。免疫はがん特有の抗原を感知し、その抗原を発現しているがん細胞を排除することができます。
|
トレードオフ
以上のような「がん抑制メカニズム」があるにもかかわらず、なぜ、がんが発生するのでしょうか。生物レベルの進化の過程で「がんは完全に抑制できる」ようにならなかったのでしょうか。
その理由は、ヒトの(生物の)胎内から墓場まで、数々の場面で細胞が "がんのように振る舞う" 必要があるからです。つまり「がん抑制メカニズムを強くしすぎると、正常に生きていくことに支障をきたす」という "トレードオフ" の関係があるのです。
|
細胞が急激に増殖したり、細胞が移動したりするといった振る舞いは、胚の発達過程からはじまって生体の傷の修復まで、数々のシチュエーションで必要になります。しかしこのような振る舞いは、まさにがん細胞が得意とするものなのです。
|
がん抑制遺伝子であるTP53が過敏だと細胞の早期老化につながったり、炎症が過度に引き起こされることが分かっています。つまり、細胞を自由にさせ過ぎるとがんのリスクが高まるが、逆に細胞の自由度を抑制し過ぎれば、成長が止まったり生殖に失敗する恐れが出てくるのです。本書の第4章、「がんは胎内から墓場まで」では、こういった "トレードオフ" の例が詳細に語られています。
本書の第5章は「がんはあらゆる多細胞生物に」と題されていて、植物を含む多細胞生物全般に "がん類似の" 異常増殖が見られることが説明されています。
さらに第6章「がん細胞の知られざる生活」では、がんが体内でどのように進化し、生息し、転移するのかが、研究者の立場から詳細に述べられています。
がんをいかにコントロールするか
第7章(最終章)は「がんをいかにコントロールするか」と題されていて、今後のがん治療に必要な視点が述べられています。
「がん = 進化しつつある体内微小環境」であり、がん組織は治療(抗がん剤、放射線など)への抵抗性があるように進化します。治療により一時的に多くのがん細胞が死滅したとしても、そのあとに残った抵抗性のあるがん細胞が一挙に増大して、結果として手が着けられなくなることが多々あります。
がんは「本質的に体の一部」です。従ってそれを「攻撃する」とか「根絶やしにする」といった考え方はまずいのです。
|
「実際にはもっと攻撃性の低い治療法が存在するのに、それを軽視するか完全に無視してしまうかするおそれがある」と著者が書いているのは、「攻撃性の低い治療法の方が、結果として患者を延命させる効果が高い、ないしは治癒させる確率が高い」ことが十分に考えられるからです。医学界には「攻撃性が弱い」という理由で使われなくなった抗がん剤がいろいろありそうです。
では「がん = 進化しつつある体内微小環境」という視点にたつと、どのような治療方法が考えられるのでしょうか。そのヒントは「総合的病害虫管理」にあります。病害虫が農薬に対する耐性をつけることは常識化していますが、そのことを前提にしたのが総合的病害虫管理です。
|
ポイントは引用の最後にある「病害虫を根絶やしにするのではなく、長期的な個体数管理ができるようにする」というところです。この考え方をがん治療に応用できないか。
それを始めたのが、米国の腫瘍学者、ロバート・ゲイトンビーです。彼の治療は「適応療法」と呼ばれています。
|
本書ではゲイトンビーの「適応療法」のやり方が詳細に述べられています。
|
引用の最後のパラグラフにあるように、「遺伝的に均一な細胞で構成されている早期に発見された腫瘍」の場合は、高用量の抗がん剤で完治できる可能性があるわけです。適用療法はあくまで腫瘍組織の精密な検査とセットで行うものです。
ゲイトンビーは数々の動物実験をしたあと、2016年に患者に対する臨床試験を始めました。
|
がんが「体細胞の進化」であるという視点にたつと、適応療法以外にも治療のアイデアが浮かびます。その一つが「おとり薬」です。
|
この「おとり薬」は、上の引用にあるように試験管レベルの研究ですが、こういう発想がでてくるのも「体細胞の進化」という視点でがんを見ているからです。次の「腫瘍に資源を与える」も、根本の見方は同じです。
|
本書に「細胞版共有地の悲劇」という話が出てきます。「共有地の悲劇」とは、共有の牧草地で各人が銘々勝手に放牧すると草が食べ尽くされて共倒れに陥るという寓話です。
がん組織が組織周辺の資源を消費し尽くしたら「共有地の悲劇」が起こり、がん細胞は全滅します(資源不足、老廃物を解毒できない、など)。がんがこれを逃れるように進化するには、
| もっと多くの資源を得るべくシグナルを送る | |
| 新天地に移動する |
ですが、このように進化するとまずい事態になります。そうなるよりも、がんに資源を与える方がよい。そういう考え方です。
体本来の機能によるコントロール
進化の視点からがんのコントロールを考えるとき、適応療法以外にもう一つ重要なポイントがあります。生物が進化の過程で得た「がんを抑制するメカニズム」を使う、つまり体本来の機能を使うことです。
がん細胞は、ヒトが本来もっている「がんを抑制するメカニズム」から逃れるための仕掛けを使います。この仕掛けを無効にするような治療です。一つの方法は、がん抑制遺伝子(TP53など)が変異しているとき、その機能を回復することです。これは研究段階にあります。さらに本書では「ご近所の目 = 地区レベルの監視システム」と「体内の警察隊 = 免疫」の活用があげられています。
|
この引用部分から類推できることは、がん細胞が出す "傷を治癒するという偽のシグナル" をブロックできれば、周囲の細胞の監視によってがん細胞を排除できる可能性があるわけです(可能性の一例ですが)。こういったタイプのがん治療は、今後の研究に負うところが多いようです。
本書からは離れますが、2021年4月8日放送の NHK BSプレミアム「ヒューマニエンス "がん" それは宿命との戦い」に、京都大学の藤田恭之教授が出演されました。藤田教授が示された映像は、腎臓の上皮細胞(表面の細胞)にできた"がん予備軍"(異常増殖)を、周囲の細胞が協力してはじき出し、それが尿といっしょに排出されるものでした。
番組では細胞のこういった機能を「細胞競合」と呼んでいましたが、藤田教授がなぜ細胞競合を研究されているかというと、もちろん、がんの治療に役立てたいからです。
番組では細胞のこういった機能を「細胞競合」と呼んでいましたが、藤田教授がなぜ細胞競合を研究されているかというと、もちろん、がんの治療に役立てたいからです。
2つ目は「体内の警察隊 = 免疫」の活用で、こちらの方は既に実用化されています。
|
「免疫チェックポイント阻害療法」は、本庶佑先生が開発の道を開かれたものです。先生が2018年のノーベル医学生理学賞を受賞されたのは、これが画期的だと認められたからでしょう。
未来へ向けて
がんは "やっかいなルームメイト" であり、我々はこのルームメイトと一緒に暮らしていくしかありません。目標とすべきは、
がんを対処可能な慢性疾患にする
ことです。著者は本書の最後の方で次のように述べています。
|
最後に、著者が書いているギリシャ神話の神の話を紹介します。ギリシャ神話に登場する戦いの神、アレスとアテナの対照的な戦い方です。
|
戦いの神・アレス(アーレス)は男性神で、ローマ神話ではマルスです。一方、アテナは女性神で、古代ギリシャの中心都市、アテネ(アテナイ)の守護神です。
|
著者は子供の頃をアテネで暮らしたギリシャ系アメリカ人です。祖母はアテナという名前で、彼女の名前は祖母の名からとったものです。そのアテナの英語読みがアシーナ(Athena)です。著者は、未来に向けたがん治療のあり方を、自らの名前の由来になったギリシャ神話の神・アテナの戦い方になぞらえているのでした。
(次回に続く)
2022-05-21 11:11
nice!(0)




