No.122 - 自己と非自己の科学:自然免疫 [科学]
今まで4回にわたって、ヒトの「免疫」に関する話題を取り上げました。
です。これらの記事の意図は、免疫についての科学的知見が、我々の生活態度や社会での行動様式に何らかの示唆を与えるに違いないというものでした。
今回もその継続で、「自然免疫」についてです。今までは「獲得免疫」しか書いてないので、それだけではヒトの免疫システムの全貌を知ることはできません。以下、「新・現代免疫物語:抗体医薬と自然免疫の驚異」(岸本 忠三・中島 彰 著。講談社ブルーバックス 2009)と、「新しい自然免疫学」(審良 静男 監修・坂野上 淳 著。技術評論社 2010)の2冊をもとに、ヒトの自然免疫のしくみをまとめてみます。
自然免疫とは
我々がインフルエンザにかかったとき、39度を越えるような高熱になり、筋肉が痛み、関節が疼くという症状覚えます。この時点で体の中で起こっているの「自然免疫」による防御反応で、インフルエンザ・ウイルスという「非自己」を排除しようとします。獲得免疫が働き始めるのは感染後4~5日後からで、感染した特定種のインフルエンザを狙い撃ちする抗体やリンパ球が大量に増殖し、ウイルスを次々と無力化していきます。この結果、7~8日たって「だいぶよくなった」と感じるわけです。獲得免疫は「記憶」が成立するので、全く同種・同型のウイルスに2度目に感染したときには、速やかに大量の抗体が生産されて治癒します。
自然免疫は病原体に対するヒトの第1段階の防御反応であり、獲得免疫とは違って、時間をおかずに即座に反応するのが特徴です。もちろん自然免疫反応だけで治癒することもあります。この自然免疫の主役は「食細胞」であり、また同時起こる生体防御のための「炎症反応」です。
自然免疫の主役は、マクロファージ、樹状細胞、好中球などの「食細胞」と呼ばれる細胞群です。これらは主に体内の血液中に存在し、病原体に遭遇すると、それを細胞の中に取り込み、分解して「食べて」しまいます。
食細胞による異物の排除と同時に起こるのが「炎症反応」です。マクロファージ、樹状細胞が病原体を認識すると、各種の情報伝達分子(サイトカイン)が放出されます。その働きにより、患部周辺の血管が拡張し、血流がゆるやかになり、血管の透過性が増します。つまり食細胞が患部に留まりやすくなり、かつ血管から患部に滲みだしやすくなる。さらにサイトカインは食細胞を呼び寄せ、好中球を活性化し、好中球を血管に付着しやすくもします。同時に、ウイルスの活動を抑制するインターフェロンも放出されます。またウイルス感染細胞を殺すナチュラル・キラー細胞(NK細胞)と呼ばれるリンパ球も活性化されます。
患部に集まったマクロファージ、樹状細胞は病原菌を「食べる」と同時にサイトカインを出すので、これらの反応が連鎖的に拡大して次々と起こる。そういった「戦争状態」が自然免疫の現場です。炎症反応は往々にして発熱やむくみを伴います。
そこで問題は、マクロファージ、樹状細胞はどのようにして病原体を認識するのかという点です。生体内部には自己の細胞や自己由来の各種分子が溢れています。その中からから、どうやって病原体を検知するのでしょうか。
その目的のためにあるのが、TLR(Toll-Like Recepteor)です。TLRは獲得免疫とは全く別種の「非自己の認識方法」をもっています。以下、ヒトのTLRの話です。
TLR (Toll-Like Receptor:Toll様受容体)
TLRは、主にマクロファージと樹状細胞が持つタンパク質分子で、これが病原体のセンサー = 受容体(Receptor)として働きます。TLRが病原体を感知すると、シグナルが細胞内に伝達され、最終的には各種のサイトカイン(情報伝達物質)やウイルスを抑制するインターフェロンが放出され、炎症反応が起こり、他のマクロファージや樹状細胞が呼び寄せられ、自然免疫が働きます。
TLRの存在する場所は、マクロファージや樹状細胞の細胞表面と、細胞内にあるエンドソームの表面です。エンドソームは袋状の小器官(小胞の一種)で、細胞あたり約100個あります。エンドソームは細胞外の物質の取り込みと、細胞内での輸送、循環に関わっています。
TLRは、ヒトではTLR1~TLR10の10種類があり、それぞれ病原体センサーとしての働きが違っています。その形状は、細胞外に出ている「LRR領域」と細胞内の「TIR領域」に分かれます。LRR(Leucine Rich Repeat)は、ロイシン(アミノ酸の一種)が多数含まれる部分で、馬蹄形をしており、この領域が病原体のセンサーとして働きます。LRRで認識された病原体の情報はTIRに伝えられ、そこから細胞内の情報伝達物資に伝えられ、自然免疫が起動します。TIRは、免疫システムにおける情報伝達分子「インターロイキン1」の受容体(IL-1 Receptor)の相当部分と極めてよく似ているので、TIR = Toll IL-1 Receptorの名があります。
TLRのうち、TLR1/2/4/5/6 は細胞表面にあり、TLR3/7/8/9/10 はエンドソームにあって、それぞれの役割を担っています。TLRは2つのユニットが合体した「二量体」となって機能を発揮します。二量体には、同種TLRの「ホモ二量体」と、異種TLRの「ヘテロ二量体」があります。
TLRによって認識される特定分子(主に病原体由来)を「リガンド」と言いますが、各TLRがどういうリガンドを認識するかが以下です。
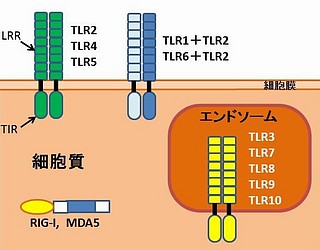
細胞表面にホモ二量体として存在するTLR2は、グラム陽性菌のペプチドグリカンを認識します。
細菌は、その細胞膜の作られ方によって3種に分類することができます。
の3種です。TLR2はこのうち「グラム陽性菌の細胞壁成分 = ペプチドグリカン」を認識します。
TLR2と同じく細胞膜の表面にあって、グラム陰性菌のLPS(リポ多糖)を認識するのがTLR4です。
TLR4がLPSを認識することを世界で初めて発表したのは、アメリカのカリフォルニア州・スクリプス研究所のブルース・ボイトラー教授でした(1998)。これがヒトにおける自然免疫機構の最初の発見になりました。ボイトラー教授はこの功績により、2011年のノーベル生理学・医学賞を受けています。大阪大学の審良静男教授もボイトラー教授とほぼ同じ時期にTLR4がLPSを認識することを発見したのですが、タッチの差でボイトラー教授に先行されたようです。なお、TLRのリガンドのほとんどは審良教授とそのグループが明らかにしました。
ちなみに2011年のノーベル生理学・医学賞の受賞者は以下の3人です。
樹状細胞と並ぶ自然免疫の主役、マクロファージを発見したのはロシアのメチニコフで、彼はその功績によって1908年のノーベル生理学・医学賞を受けました。そのためメチニコフは「自然免疫学の父」と呼ばれています。自然免疫の研究成果に対して与えられた2つのノーベル賞の100年という時間差(1908年と2011年)は、その間に自然免疫の研究が進展しなかったことを象徴しています。つまり、20世紀の免疫研究は「獲得免疫の研究」だったのです。
鞭毛をもつ微生物の、鞭毛の先端部分にあるタンパク質、フラジェリンを認識します。鞭毛はフラジェリンの「繊維」を螺旋状に束ねた構造をしていて、鞭毛微生物はこれを回転させて移動します。
人の腸に住む腸内細菌には鞭毛を持つものがあります。こういった細菌が腸管上皮細胞を突破して体内に入るとまずいことになります。また腸には食べ物と一緒に鞭毛を持つ病原菌(サルモネラ菌など)が入ってきます。そのためTLR5は、腸管上皮細胞すぐ下の樹状細胞に多く発現しています。ヒトの体はそこで鞭毛微生物の進入を監視していることになります。
細胞表面にあるヘテロ二量体、TLR1 + TLR2は、グラム陽性菌・グラム陰性菌の細胞膜にある、トリアシル・リポタンパク質(3つのアシル基をもつリポタンパク質)を認識します。
マイコプラズマの細胞膜にある、ジアシル・リポタンパク質(2つのアシル基をもつリポタンパク)を認識します。
ここからは、細胞内部のエンドソームに発現するTLRです。これらのTLRは細菌やウイルスのDNAやRNAを認識します。マクロファージや樹状細胞は、細菌やウイルスを消化してエンドソームに運び、そこで核酸(DNAやRNA)にまでバラバラにします。そこでTLRの認識機構が働きます。
ウイルスはDNA/RNAをタンパク質で覆った構造をしていますが、核酸としてDNAを持つ「DNAウイルス」と、RNAを持つ「RNAウイルス」があります。RNAウイルスの多くは1本鎖RNAを持ちますが、中には「ロタウイルス」のように2本鎖RNAを持つタイプがあります。
TLR3はこのウイルスの2本鎖RNA(dsRNA。double stranded RNA)を認識します。
多くのRNAウイルスがもつ1本鎖RNA(ssRNA。single stranded RNA)を認識します。
細菌やDNAウイルスのDNAを認識します。細菌やウイルスのDNAには、特徴的な6つの塩基の配列がしばしば現れます。これは「CpG配列」と呼ばれていて、
という、真ん中にシトシン(C)グアニン(G)をもつ配列です。CpG配列は、哺乳類のDNAにも少数ながら含まれています。しかし哺乳類のCpG配列はメチル化されている(メチル基、CH3が結合している)確率が非常に高い。そこでTLR9は「DNAの、メチル化されていないCpG配列」を認識します。このことで細菌やDNAウイルスのDNAが判別できるのです。
TLRが存在するのは、細胞の表面かエンドソームでした。これに対し、細胞質内にも「RNAセンサー」が存在することが判明しています。これはTLRファミリーとは別の、RLR(RIG-Like Receptors)と呼ばれるセンサー群です。具体的には、
・RIG-I
・MDA5
という受容体です。
1本鎖RNAウイルスは、細胞の中に進入すると増殖を始め、その過程でRNAが2本鎖になります。RLRはこの2本鎖を認識して自然免疫を発動します。エンドソーム内にあるTLR3/7/8は、マクロファージなどがウイルスを分解した結果としてのRNAを認識しますが、RLRはウイルスが細胞内に進入した初期段階で働くところに重要性があります。
RIG-IとMDA5は「担当する」ウイルスに相違があり、RIG-Iはインフルエンザ・ウイルスや日本脳炎ウイルスを、MDA5はピコルナウイスル科のRNAウイルス(脳脊髄炎、心筋炎などを起こす)を認識します。
なお細胞質内の病原体センサーには、RLR以外にも別のファミリー(NLR:NOD-Like Receptors、など)があることが知られています。
TLRが認識する「非自己」
TLRが認識する「非自己」を一覧表にまとめたものが以下です。
なおTLR10のリガンドは、参考にした本が書かれた時点では不明です。また上記の表に記した以外にもリガンドはあり、1種のTLRが復数のリガンドを認識するケースもありますが、表からは省略しました。
自然免疫から獲得免疫へ
マクロファージと樹状細胞はTLRによって病原体を認識し自然免疫を発動するのですが、同時に抗原提示という機能があり、獲得免疫の発端にもなっています。抗原提示については、No.69-70「自己と非自己の科学」で詳しく書きました。
つまり、マクロファージや樹状細胞(= 抗原提示細胞)に取り込まれた病原体は、細胞内のエンドソームに運ばれ、そこで病原体のタンパク質が分解酵素でバラバラにされます。そのタンパク質の断片が再び細胞表面に運ばれ、MHCの「溝」にはさまる格好で抗原提示される。それをヘルパーT細胞が認識する。そういった筋道で獲得免疫が発動するのでした。
そのエンドソームには、実はTLR3/TLR7/TLR8/TLR9 が「待ちかまえて」いて、病原体の核酸(DNA/RNA)を認識し、認識できれば自然免疫が発動する。このことはマクロファージや樹状細胞が、免疫全体にとって極めて重要なポジションにあることを示唆しています。
事実、21世紀の免疫学で判明したのは、マクロファージと樹状細胞は抗原提示をするだけでなく、獲得免疫を開始するトリガーを引いていることです。つまり抗原提示と同時に補助分子やサイトカインを放出し、未成熟T細胞を活性化T細胞(ヘルパーT細胞)へと変化させます。T細胞は活性化されてはじめてB細胞に抗体生産の指示を出せるようになるのです。
自然免疫の主役は、実は「ヒトの免疫システム全体の指令塔」でもあるのです。
自己と非自己の認識
以上が「新・現代免疫物語」と「新しい自然免疫学」という2冊の本による自然免疫のメカニズムの要点です。以下は「感想」ないしは「まとめ」です。
自然免疫と獲得免疫(No.69-70「自己と非自己の科学」)という「ヒトの免疫のしくみ全体」を眺めてみると、非自己を自己から区別するやり方は、異物や異分子を排除する一般的な方法論に添っていることがわかります。それはブラック・リスト方式とホワイト・リスト方式の併用だと言えるでしょう。以下、ブラックとは非自己、ホワイトとは自己を指すことにします。
自然免疫は「ブラック・リスト方式による非自己の認識」です。何がブラックか、自然界に存在するブラックの典型的なパターンがリスト化されていて、そのリストに載っているものが排除されます。このリストは、ヒトではわずか10項目という小ささです(TLR1~TLR10)。こんな小さなリストで有効なのだろうかと思ってしまいますが、意外にも有効なのですね。我々は毎日、毎時、病原体の進入を受けています。食物といっしょに腸から、呼吸を通して肺から、また皮膚からも病原体は進入してきます。それらを水際で、速効性があるやり方で排除するのが自然免疫です。我々は普通意識することはないのですが、大多数の防御は自然免疫でこと足りていると考えられます。
自然免疫は、脊椎動物だけではなく自然界の幅広い生物が持っています。10項目のリストは、生命の長い進化の過程で「選りすぐられてきたブラック・リスト」でしょう。ここにリストアップされているのは「病原体に共通的にみられる分子パターン」なので、非常に効率的です。
一方、獲得免疫の出発点は「ホワイト・リスト」です。No.69-70「自己と非自己の科学」を振り返ってみると分かるように、ヒトの細胞表面にはMHCという自己の標識があり、この標識に自己由来のタンパク質の断片が提示されているものが「ホワイト」ということになります。病原体由来のタンパク質がマクロファージ、樹状細胞、B細胞などの「抗原提示細胞」で分解され、その断片がMHCに提示されると、そのMHCは「ホワイトではない標識」ということになる。
獲得免疫が「ホワイトでない標識」を見つけるやり方は独特です。まず、ランダムな遺伝子組み替えでヘルパーT細胞群が作られます。ヘルパーT細胞の抗原認識分子(T細胞受容体 = TCR)は、細胞ごとに違っています(1兆種類ありうる)。そして、自己のMHCと反応するTCRをもつヘルパーT細胞は胸線で死滅し、取り除かれます。生き残ったヘルパーT細胞のどれかがMHCと反応するとしたら、そのMHCは「非自己由来の抗原の断片を提示しているMHC」であり、つまり「ホワイトでない標識」ということになる。
「ホワイトでない標識」がいったん認識されると、獲得免疫が発動し、B細胞が抗体を作り、病原体が駆除されます。と同時に、特定の非自己に反応したヘルパーT細胞や、特定の非自己を攻撃する抗体を作り出したB細胞は、同一のものが大量に複製されて記憶T細胞、記憶B細胞となって残る。この「免疫記憶」が第2のブラック・リストになります。「第2のブラック・リスト」は、自然免疫のような「病原体の分子の典型的パターン」といったものではなく、たとえば「麻疹ウイルス」「インフルエンザ・ウイルス XX型」といった、病原体を直接的に示す情報です。かつ、生まれてからどういう病原体と遭遇するかによって、人それぞれリストが違っています。決して先天的なものではなく、後天的であり、適応的であり、自己組織化で作り上げられていくものです。
比較すると、自然免疫は即応的で、かつ効率的です。しかし、10項目の短いブラック・リストでは排除すべき非自己の全部は尽くせない。また、10項目のブラック・リストは遺伝的に決まっていて、そこに新しい1項目を追加するには遺伝子の変化(=ヒトの進化)が必要です。それには極めて長い時間がかかります。
それに比較して、ランダムな遺伝子組み替えと免疫記憶を通して作られる「第2のブラック・リスト」は、進化を必要としません。環境の変化によってどんどん変わっていけるし、また「種」として重要な、個体ごとの多様性も獲得できます。しかしそれだけに、必然的に組み込まれている「曖昧性」があって、自己免疫疾患を引き起こすような「危うさ」を内包している。
自然免疫のしくみが分かると、獲得免疫の意味もよく理解できます。この2つは相い補って「自己」を維持していることがよく理解できるのです。
病原体で引き起こされる疾病の治療や、ガンの治療には、ヒトの免疫の理解が欠かせません。その典型は「新・現代免疫物語」に書かれている「抗体医薬」でしょう。またガンの治療は、今後は免疫療法が大きく発展すると言われています。難病(多くが自己免疫疾患)やアレルギーの治療に免疫の理解が必要なことは言うまでもありません。さらに No.119-120「不在という伝染病」に書いたように、免疫を理解するには人間と共生している体内の微生物(常在菌)の理解も必要になってきました。その、常在菌と免疫の関係の研究は始まったばかりです。
「免疫」は「脳」と並んで、21世紀の知のフロンティアだという感じを強く持ちます。
自然免疫に関する最近の研究成果が新聞に載っていましたので、それを引用します。
引用の最初の方に「ウイルスのRNA(リボ核酸)を構成する塩基とRNAの断片を同時に認識」とあり、終わりの方には「1本鎖RNAが分解してできたウリジンと呼ぶ塩基とRNAやRNA断片をそれぞれ別の場所でとらえ」とあって記述不統一に見えますが、「ウリジン」とはRNAの構成塩基の一つである「ウラシル」が分解して糖と結合して出来たものなので、同じことを言っています。とにかく、RNA本体(断片でもよい)とRNAが分解してできた物質が同時にないとTLR8が引き起こす免疫反応は起こらないというのが記事の要点です。
ほとんどの難病は自己免疫疾患であり、その治療薬の開発には免疫の詳細なメカニズムの解明が欠かせません。自然免疫の研究の最先端で何が行われているのか、その一端を紹介した良い記事だと思いました。
| 自己と非自己の科学 | |||
| 「不在」という伝染病 (免疫関連疾患の話) |
です。これらの記事の意図は、免疫についての科学的知見が、我々の生活態度や社会での行動様式に何らかの示唆を与えるに違いないというものでした。
今回もその継続で、「自然免疫」についてです。今までは「獲得免疫」しか書いてないので、それだけではヒトの免疫システムの全貌を知ることはできません。以下、「新・現代免疫物語:抗体医薬と自然免疫の驚異」(岸本 忠三・中島 彰 著。講談社ブルーバックス 2009)と、「新しい自然免疫学」(審良 静男 監修・坂野上 淳 著。技術評論社 2010)の2冊をもとに、ヒトの自然免疫のしくみをまとめてみます。
|
|
自然免疫とは
我々がインフルエンザにかかったとき、39度を越えるような高熱になり、筋肉が痛み、関節が疼くという症状覚えます。この時点で体の中で起こっているの「自然免疫」による防御反応で、インフルエンザ・ウイルスという「非自己」を排除しようとします。獲得免疫が働き始めるのは感染後4~5日後からで、感染した特定種のインフルエンザを狙い撃ちする抗体やリンパ球が大量に増殖し、ウイルスを次々と無力化していきます。この結果、7~8日たって「だいぶよくなった」と感じるわけです。獲得免疫は「記憶」が成立するので、全く同種・同型のウイルスに2度目に感染したときには、速やかに大量の抗体が生産されて治癒します。
自然免疫は病原体に対するヒトの第1段階の防御反応であり、獲得免疫とは違って、時間をおかずに即座に反応するのが特徴です。もちろん自然免疫反応だけで治癒することもあります。この自然免疫の主役は「食細胞」であり、また同時起こる生体防御のための「炎症反応」です。
| 食細胞 |
自然免疫の主役は、マクロファージ、樹状細胞、好中球などの「食細胞」と呼ばれる細胞群です。これらは主に体内の血液中に存在し、病原体に遭遇すると、それを細胞の中に取り込み、分解して「食べて」しまいます。
| 炎症反応 |
食細胞による異物の排除と同時に起こるのが「炎症反応」です。マクロファージ、樹状細胞が病原体を認識すると、各種の情報伝達分子(サイトカイン)が放出されます。その働きにより、患部周辺の血管が拡張し、血流がゆるやかになり、血管の透過性が増します。つまり食細胞が患部に留まりやすくなり、かつ血管から患部に滲みだしやすくなる。さらにサイトカインは食細胞を呼び寄せ、好中球を活性化し、好中球を血管に付着しやすくもします。同時に、ウイルスの活動を抑制するインターフェロンも放出されます。またウイルス感染細胞を殺すナチュラル・キラー細胞(NK細胞)と呼ばれるリンパ球も活性化されます。
患部に集まったマクロファージ、樹状細胞は病原菌を「食べる」と同時にサイトカインを出すので、これらの反応が連鎖的に拡大して次々と起こる。そういった「戦争状態」が自然免疫の現場です。炎症反応は往々にして発熱やむくみを伴います。
そこで問題は、マクロファージ、樹状細胞はどのようにして病原体を認識するのかという点です。生体内部には自己の細胞や自己由来の各種分子が溢れています。その中からから、どうやって病原体を検知するのでしょうか。
その目的のためにあるのが、TLR(Toll-Like Recepteor)です。TLRは獲得免疫とは全く別種の「非自己の認識方法」をもっています。以下、ヒトのTLRの話です。
| TLRの「Toll」とは、もともとショウジョウバエの細胞表面にあるタンパク質分子でした。フランスのジュール・ホフマンは、Tollがカビの菌を認識し、それがトリガーとなって抗菌ペプチド(カビの繁殖を抑制するアミノ酸の連鎖分子)が作られることを発見しました(1996)。そして、このTollとよく似た分子が人間にもあることが分かったのです。これが「Toll-Like」の由来です。 |
TLR (Toll-Like Receptor:Toll様受容体)
TLRは、主にマクロファージと樹状細胞が持つタンパク質分子で、これが病原体のセンサー = 受容体(Receptor)として働きます。TLRが病原体を感知すると、シグナルが細胞内に伝達され、最終的には各種のサイトカイン(情報伝達物質)やウイルスを抑制するインターフェロンが放出され、炎症反応が起こり、他のマクロファージや樹状細胞が呼び寄せられ、自然免疫が働きます。
TLRの存在する場所は、マクロファージや樹状細胞の細胞表面と、細胞内にあるエンドソームの表面です。エンドソームは袋状の小器官(小胞の一種)で、細胞あたり約100個あります。エンドソームは細胞外の物質の取り込みと、細胞内での輸送、循環に関わっています。
TLRは、ヒトではTLR1~TLR10の10種類があり、それぞれ病原体センサーとしての働きが違っています。その形状は、細胞外に出ている「LRR領域」と細胞内の「TIR領域」に分かれます。LRR(Leucine Rich Repeat)は、ロイシン(アミノ酸の一種)が多数含まれる部分で、馬蹄形をしており、この領域が病原体のセンサーとして働きます。LRRで認識された病原体の情報はTIRに伝えられ、そこから細胞内の情報伝達物資に伝えられ、自然免疫が起動します。TIRは、免疫システムにおける情報伝達分子「インターロイキン1」の受容体(IL-1 Receptor)の相当部分と極めてよく似ているので、TIR = Toll IL-1 Receptorの名があります。
TLRのうち、TLR1/2/4/5/6 は細胞表面にあり、TLR3/7/8/9/10 はエンドソームにあって、それぞれの役割を担っています。TLRは2つのユニットが合体した「二量体」となって機能を発揮します。二量体には、同種TLRの「ホモ二量体」と、異種TLRの「ヘテロ二量体」があります。
TLRによって認識される特定分子(主に病原体由来)を「リガンド」と言いますが、各TLRがどういうリガンドを認識するかが以下です。

| TLR2 |
細胞表面にホモ二量体として存在するTLR2は、グラム陽性菌のペプチドグリカンを認識します。
細菌は、その細胞膜の作られ方によって3種に分類することができます。
| 細胞膜の外側に、ペプチドグリカンでできた厚い「細胞壁」をもつ細菌です。「グラム染色」という手法で染まる(=陽性)ため、この名があります。ペプチドグリカンは、多糖類にペプチド鎖(アミノ酸の連鎖分子)が結合したものです。 | |||
| ペプチドグリカンの細胞壁は薄く、その外側に「リポ多糖(LPS:Lipo Poly Saccharide)」の防御層を持っています。この種の細菌はグラム染色で染まりません。LPSは多糖類と脂質からできています。 | |||
| 細胞壁がなく、細胞膜がむき出しになっています。従って細菌は不定形であり、通常の細菌が通らないような細かいフィルターもすり抜けます。往々にして肺炎を引き起こします。 |
の3種です。TLR2はこのうち「グラム陽性菌の細胞壁成分 = ペプチドグリカン」を認識します。
| TLR4 |
TLR2と同じく細胞膜の表面にあって、グラム陰性菌のLPS(リポ多糖)を認識するのがTLR4です。
TLR4がLPSを認識することを世界で初めて発表したのは、アメリカのカリフォルニア州・スクリプス研究所のブルース・ボイトラー教授でした(1998)。これがヒトにおける自然免疫機構の最初の発見になりました。ボイトラー教授はこの功績により、2011年のノーベル生理学・医学賞を受けています。大阪大学の審良静男教授もボイトラー教授とほぼ同じ時期にTLR4がLPSを認識することを発見したのですが、タッチの差でボイトラー教授に先行されたようです。なお、TLRのリガンドのほとんどは審良教授とそのグループが明らかにしました。
ちなみに2011年のノーベル生理学・医学賞の受賞者は以下の3人です。
ブルース・ボイトラー(アメリカ)
|
樹状細胞と並ぶ自然免疫の主役、マクロファージを発見したのはロシアのメチニコフで、彼はその功績によって1908年のノーベル生理学・医学賞を受けました。そのためメチニコフは「自然免疫学の父」と呼ばれています。自然免疫の研究成果に対して与えられた2つのノーベル賞の100年という時間差(1908年と2011年)は、その間に自然免疫の研究が進展しなかったことを象徴しています。つまり、20世紀の免疫研究は「獲得免疫の研究」だったのです。
| TLR5 |
鞭毛をもつ微生物の、鞭毛の先端部分にあるタンパク質、フラジェリンを認識します。鞭毛はフラジェリンの「繊維」を螺旋状に束ねた構造をしていて、鞭毛微生物はこれを回転させて移動します。
人の腸に住む腸内細菌には鞭毛を持つものがあります。こういった細菌が腸管上皮細胞を突破して体内に入るとまずいことになります。また腸には食べ物と一緒に鞭毛を持つ病原菌(サルモネラ菌など)が入ってきます。そのためTLR5は、腸管上皮細胞すぐ下の樹状細胞に多く発現しています。ヒトの体はそこで鞭毛微生物の進入を監視していることになります。
| TLR1 + TLR2 |
細胞表面にあるヘテロ二量体、TLR1 + TLR2は、グラム陽性菌・グラム陰性菌の細胞膜にある、トリアシル・リポタンパク質(3つのアシル基をもつリポタンパク質)を認識します。
| TLR6 + TLR2 |
マイコプラズマの細胞膜にある、ジアシル・リポタンパク質(2つのアシル基をもつリポタンパク)を認識します。
| TLR3 |
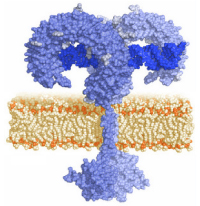
| |||
|
TLR3の二量体が二本鎖RNAを認識している図。TLRのLRR領域は馬蹄形をしている。2つの「馬蹄」の間に水平に描かれているのが二本鎖RNAである。
http://www.invivogen.com/review-tlrより引用。 | |||
ウイルスはDNA/RNAをタンパク質で覆った構造をしていますが、核酸としてDNAを持つ「DNAウイルス」と、RNAを持つ「RNAウイルス」があります。RNAウイルスの多くは1本鎖RNAを持ちますが、中には「ロタウイルス」のように2本鎖RNAを持つタイプがあります。
TLR3はこのウイルスの2本鎖RNA(dsRNA。double stranded RNA)を認識します。
| TLR7、およびTLR8 |
多くのRNAウイルスがもつ1本鎖RNA(ssRNA。single stranded RNA)を認識します。
| TLR9 |
細菌やDNAウイルスのDNAを認識します。細菌やウイルスのDNAには、特徴的な6つの塩基の配列がしばしば現れます。これは「CpG配列」と呼ばれていて、
| GACGTT GTCGTT
|
という、真ん中にシトシン(C)グアニン(G)をもつ配列です。CpG配列は、哺乳類のDNAにも少数ながら含まれています。しかし哺乳類のCpG配列はメチル化されている(メチル基、CH3が結合している)確率が非常に高い。そこでTLR9は「DNAの、メチル化されていないCpG配列」を認識します。このことで細菌やDNAウイルスのDNAが判別できるのです。
TLRが存在するのは、細胞の表面かエンドソームでした。これに対し、細胞質内にも「RNAセンサー」が存在することが判明しています。これはTLRファミリーとは別の、RLR(RIG-Like Receptors)と呼ばれるセンサー群です。具体的には、
・RIG-I
・MDA5
という受容体です。
1本鎖RNAウイルスは、細胞の中に進入すると増殖を始め、その過程でRNAが2本鎖になります。RLRはこの2本鎖を認識して自然免疫を発動します。エンドソーム内にあるTLR3/7/8は、マクロファージなどがウイルスを分解した結果としてのRNAを認識しますが、RLRはウイルスが細胞内に進入した初期段階で働くところに重要性があります。
RIG-IとMDA5は「担当する」ウイルスに相違があり、RIG-Iはインフルエンザ・ウイルスや日本脳炎ウイルスを、MDA5はピコルナウイスル科のRNAウイルス(脳脊髄炎、心筋炎などを起こす)を認識します。
なお細胞質内の病原体センサーには、RLR以外にも別のファミリー(NLR:NOD-Like Receptors、など)があることが知られています。
TLRが認識する「非自己」
TLRが認識する「非自己」を一覧表にまとめたものが以下です。
| 細菌 | ウイルス | リガンド(認識される特定分子) | ||
| ● | グラム陽性菌の細胞壁成分(ペプチドグリカン) | |||
| ● | グラム陰性菌の細胞壁成分(LPS:リポ多糖) | |||
| ● | 鞭毛微生物の鞭毛成分(フラジェリン) | |||
| ● | 細菌の細胞膜成分(トリアシル・リポタンパク質) | |||
| ● | マイコプラズマの細胞膜成分(ジアシル・リポタンパク質) | |||
| ● | 2本鎖RNA(dsRNA。double stranded RNA) | |||
| TLR7、TLR8 | ● | 1本鎖RNA(ssRNA。single stranded RNA) | ||
| ● | ● | DNAのCpG配列(メチル化されていないもの) |
なおTLR10のリガンドは、参考にした本が書かれた時点では不明です。また上記の表に記した以外にもリガンドはあり、1種のTLRが復数のリガンドを認識するケースもありますが、表からは省略しました。
自然免疫から獲得免疫へ
マクロファージと樹状細胞はTLRによって病原体を認識し自然免疫を発動するのですが、同時に抗原提示という機能があり、獲得免疫の発端にもなっています。抗原提示については、No.69-70「自己と非自己の科学」で詳しく書きました。
つまり、マクロファージや樹状細胞(= 抗原提示細胞)に取り込まれた病原体は、細胞内のエンドソームに運ばれ、そこで病原体のタンパク質が分解酵素でバラバラにされます。そのタンパク質の断片が再び細胞表面に運ばれ、MHCの「溝」にはさまる格好で抗原提示される。それをヘルパーT細胞が認識する。そういった筋道で獲得免疫が発動するのでした。
そのエンドソームには、実はTLR3/TLR7/TLR8/TLR9 が「待ちかまえて」いて、病原体の核酸(DNA/RNA)を認識し、認識できれば自然免疫が発動する。このことはマクロファージや樹状細胞が、免疫全体にとって極めて重要なポジションにあることを示唆しています。
事実、21世紀の免疫学で判明したのは、マクロファージと樹状細胞は抗原提示をするだけでなく、獲得免疫を開始するトリガーを引いていることです。つまり抗原提示と同時に補助分子やサイトカインを放出し、未成熟T細胞を活性化T細胞(ヘルパーT細胞)へと変化させます。T細胞は活性化されてはじめてB細胞に抗体生産の指示を出せるようになるのです。
自然免疫の主役は、実は「ヒトの免疫システム全体の指令塔」でもあるのです。
自己と非自己の認識
以上が「新・現代免疫物語」と「新しい自然免疫学」という2冊の本による自然免疫のメカニズムの要点です。以下は「感想」ないしは「まとめ」です。
自然免疫と獲得免疫(No.69-70「自己と非自己の科学」)という「ヒトの免疫のしくみ全体」を眺めてみると、非自己を自己から区別するやり方は、異物や異分子を排除する一般的な方法論に添っていることがわかります。それはブラック・リスト方式とホワイト・リスト方式の併用だと言えるでしょう。以下、ブラックとは非自己、ホワイトとは自己を指すことにします。
自然免疫は「ブラック・リスト方式による非自己の認識」です。何がブラックか、自然界に存在するブラックの典型的なパターンがリスト化されていて、そのリストに載っているものが排除されます。このリストは、ヒトではわずか10項目という小ささです(TLR1~TLR10)。こんな小さなリストで有効なのだろうかと思ってしまいますが、意外にも有効なのですね。我々は毎日、毎時、病原体の進入を受けています。食物といっしょに腸から、呼吸を通して肺から、また皮膚からも病原体は進入してきます。それらを水際で、速効性があるやり方で排除するのが自然免疫です。我々は普通意識することはないのですが、大多数の防御は自然免疫でこと足りていると考えられます。
自然免疫は、脊椎動物だけではなく自然界の幅広い生物が持っています。10項目のリストは、生命の長い進化の過程で「選りすぐられてきたブラック・リスト」でしょう。ここにリストアップされているのは「病原体に共通的にみられる分子パターン」なので、非常に効率的です。
一方、獲得免疫の出発点は「ホワイト・リスト」です。No.69-70「自己と非自己の科学」を振り返ってみると分かるように、ヒトの細胞表面にはMHCという自己の標識があり、この標識に自己由来のタンパク質の断片が提示されているものが「ホワイト」ということになります。病原体由来のタンパク質がマクロファージ、樹状細胞、B細胞などの「抗原提示細胞」で分解され、その断片がMHCに提示されると、そのMHCは「ホワイトではない標識」ということになる。
獲得免疫が「ホワイトでない標識」を見つけるやり方は独特です。まず、ランダムな遺伝子組み替えでヘルパーT細胞群が作られます。ヘルパーT細胞の抗原認識分子(T細胞受容体 = TCR)は、細胞ごとに違っています(1兆種類ありうる)。そして、自己のMHCと反応するTCRをもつヘルパーT細胞は胸線で死滅し、取り除かれます。生き残ったヘルパーT細胞のどれかがMHCと反応するとしたら、そのMHCは「非自己由来の抗原の断片を提示しているMHC」であり、つまり「ホワイトでない標識」ということになる。
「ホワイトでない標識」がいったん認識されると、獲得免疫が発動し、B細胞が抗体を作り、病原体が駆除されます。と同時に、特定の非自己に反応したヘルパーT細胞や、特定の非自己を攻撃する抗体を作り出したB細胞は、同一のものが大量に複製されて記憶T細胞、記憶B細胞となって残る。この「免疫記憶」が第2のブラック・リストになります。「第2のブラック・リスト」は、自然免疫のような「病原体の分子の典型的パターン」といったものではなく、たとえば「麻疹ウイルス」「インフルエンザ・ウイルス XX型」といった、病原体を直接的に示す情報です。かつ、生まれてからどういう病原体と遭遇するかによって、人それぞれリストが違っています。決して先天的なものではなく、後天的であり、適応的であり、自己組織化で作り上げられていくものです。
比較すると、自然免疫は即応的で、かつ効率的です。しかし、10項目の短いブラック・リストでは排除すべき非自己の全部は尽くせない。また、10項目のブラック・リストは遺伝的に決まっていて、そこに新しい1項目を追加するには遺伝子の変化(=ヒトの進化)が必要です。それには極めて長い時間がかかります。
それに比較して、ランダムな遺伝子組み替えと免疫記憶を通して作られる「第2のブラック・リスト」は、進化を必要としません。環境の変化によってどんどん変わっていけるし、また「種」として重要な、個体ごとの多様性も獲得できます。しかしそれだけに、必然的に組み込まれている「曖昧性」があって、自己免疫疾患を引き起こすような「危うさ」を内包している。
自然免疫のしくみが分かると、獲得免疫の意味もよく理解できます。この2つは相い補って「自己」を維持していることがよく理解できるのです。
病原体で引き起こされる疾病の治療や、ガンの治療には、ヒトの免疫の理解が欠かせません。その典型は「新・現代免疫物語」に書かれている「抗体医薬」でしょう。またガンの治療は、今後は免疫療法が大きく発展すると言われています。難病(多くが自己免疫疾患)やアレルギーの治療に免疫の理解が必要なことは言うまでもありません。さらに No.119-120「不在という伝染病」に書いたように、免疫を理解するには人間と共生している体内の微生物(常在菌)の理解も必要になってきました。その、常在菌と免疫の関係の研究は始まったばかりです。
「免疫」は「脳」と並んで、21世紀の知のフロンティアだという感じを強く持ちます。
| 補記 |
自然免疫に関する最近の研究成果が新聞に載っていましたので、それを引用します。
|
引用の最初の方に「ウイルスのRNA(リボ核酸)を構成する塩基とRNAの断片を同時に認識」とあり、終わりの方には「1本鎖RNAが分解してできたウリジンと呼ぶ塩基とRNAやRNA断片をそれぞれ別の場所でとらえ」とあって記述不統一に見えますが、「ウリジン」とはRNAの構成塩基の一つである「ウラシル」が分解して糖と結合して出来たものなので、同じことを言っています。とにかく、RNA本体(断片でもよい)とRNAが分解してできた物質が同時にないとTLR8が引き起こす免疫反応は起こらないというのが記事の要点です。
ほとんどの難病は自己免疫疾患であり、その治療薬の開発には免疫の詳細なメカニズムの解明が欠かせません。自然免疫の研究の最先端で何が行われているのか、その一端を紹介した良い記事だと思いました。
2014-08-08 19:27
nice!(0)
トラックバック(0)





